溶解度質(zhì)量分?jǐn)?shù)物質(zhì)的量濃度的計算和換算
一、知識概要
(一)有關(guān)溶解度的計算
在一定溫度下的飽和溶液中,溶質(zhì)、溶劑、溶液間有一定量的關(guān)系。由此可進(jìn)行以下計算:
(1)根據(jù)飽和溶液溶質(zhì)、溶劑的量推算溶解度;(2)根據(jù)溶解度求算飽和溶液所含的溶劑和溶質(zhì)量;(3)根據(jù)溶解度求算飽和溶液在蒸發(fā)掉一定量溶劑后析出的結(jié)晶量;(4)由于物質(zhì)在不同溫度下溶解度不同,可以根據(jù)不同溫度下的溶解度求算出一定量飽和溶液由于溫度改變(或同時有溶劑量改變),析出結(jié)晶的量。(5)飽和溶液中溶解度與溶質(zhì)的質(zhì)量分?jǐn)?shù)的換算。
一定溫度下,某飽和溶液溶質(zhì)的溶解度:
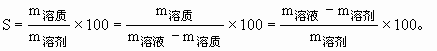
解題時要熟練運(yùn)用下列比列關(guān)系:飽和溶液中

(二)有關(guān)質(zhì)量分?jǐn)?shù)、物質(zhì)的量濃度的計算
有關(guān)質(zhì)量分?jǐn)?shù)的計算比較簡單,但注意兩點(diǎn):一是含結(jié)晶水化合物的濃度均按無水物含量計算;二是有些溶質(zhì)溶解后與水發(fā)生了反應(yīng),其不能直接按原物質(zhì)的量表示,如SO3、Na2O2溶于水,溶液濃度按H2SO4、NaOH含量計算。
與物質(zhì)的量濃度有關(guān)的計算有:(1)配制一定物質(zhì)的量濃度所需溶質(zhì)、溶劑量或濃溶液稀釋用量的計算;(2)根據(jù)所溶溶質(zhì)的量求算物質(zhì)的量濃度、離子物質(zhì)的量濃度;(3)物質(zhì)的量濃度與質(zhì)量分?jǐn)?shù)的換算。
二、例題分析
例1已知某飽和氯化鈉溶液體積為VmL溶液密度為dg/cm3,質(zhì)量分?jǐn)?shù)為w%,物質(zhì)的量濃度為Cmol/L,溶液中含NaCl的質(zhì)量為mg。
(1)用w表示在該溫度下NaCl的溶解度是____。
(2)用m、V表示溶液的物質(zhì)的量濃度是____。
(3)用w、d表示溶液的物質(zhì)的量濃度是____。
(4)用c、d表示溶液的質(zhì)量分?jǐn)?shù)是____。
解析:本題沒有給出具體數(shù)值,只給出抽象符號。
解題關(guān)鍵是:一要準(zhǔn)確把握飽和溶液溶解度、質(zhì)量分?jǐn)?shù)的本質(zhì)區(qū)別和相互聯(lián)系,二要理解密度是質(zhì)量分?jǐn)?shù)與物質(zhì)的量濃度相互換算的橋梁。
(1)要求把飽和溶液的質(zhì)量分?jǐn)?shù)換算為溶解度:
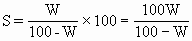
(2)要求用VmL溶液中的溶質(zhì)質(zhì)量m來表示物質(zhì)的量濃度:

(3)要求把質(zhì)量分?jǐn)?shù)(W%)換算為物質(zhì)的量濃度:
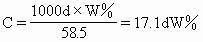
(4)要求把物質(zhì)的量濃度換算為質(zhì)量分?jǐn)?shù),實(shí)質(zhì)是(3)小題的逆運(yùn)算:
例2用Na2SO3和硫粉在水溶液中加熱反應(yīng),可制得Na2S2O3。10℃和70℃時,Na2S2O3在100g水中的溶解度分別為60.0g和212g。常溫下,從溶液中析出的晶體是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl。現(xiàn)取15.1gNa2SO3,溶于80.0mL水,另取5.00g硫粉,用少許乙醇潤濕后(以便硫能被水浸潤),加到上述溶液中。用小火加熱至微沸,反應(yīng)約1h后過濾。濾液在100℃經(jīng)蒸發(fā)、濃縮、冷卻至10℃后析出Na2S2O3·5H2O晶體。
(1)若加入的硫粉不用乙醇潤濕,對反應(yīng)的影響是______。(填寫選項字母)
A.會降低反應(yīng)速率B.需要提高反應(yīng)溫度
C.將增大反應(yīng)體系的pHD.會減少產(chǎn)量
(2)反應(yīng)1h后過濾,其目的是_______。
(3)濾液中除Na2S2O3和可能未反應(yīng)完全的Na2SO3外,最可能存在的無機(jī)雜質(zhì)是_______。它是由_______產(chǎn)生的。如果濾液中該雜質(zhì)的含量不很低,其檢測的方法是:______。
(4)設(shè)Na2SO3跟硫粉完全反應(yīng),當(dāng)將濾液蒸發(fā)濃縮后,冷卻至70℃,溶液的體積約30mL,該溶液是否達(dá)到飽和?試通過計算說明(70℃時,Na2S2O3飽和溶液的密度為1.17g/cm3)。
(5)若要計算在100℃下將溶液蒸發(fā)至體積為30.0mL,再冷卻至10℃時所能得到的Na2S2O3·5H2O的質(zhì)量,你認(rèn)為_______。(填寫一個選項的字母)
A.前面提供的數(shù)據(jù)已經(jīng)足夠
B.還需要提供100℃時溶液的密度(1.14g/cm3)
C.還需要提供結(jié)晶后剩余溶液的體積(10.0mL)
(6)根據(jù)第(5)小題你的選擇(如選A則直接計算,如選B或C則可選用其數(shù)據(jù)),計算從10℃,30.0mL溶液中結(jié)晶而出的Na2S2O3·5H2O的質(zhì)量。
解析:(1)硫不溶于水,微溶于酒精。題給信息“用乙醇潤濕后的硫能被水浸潤”,若不用乙醇潤濕硫粉,則硫必然與水溶液中的Na2SO3“接觸不良”而降低反應(yīng)速率,并會減少產(chǎn)量,答案應(yīng)選A、D。
(2)Na2SO3+S=Na2S2O3
n(S)=5/32=0.16(mol),
n(Na2SO3)=15.1/126=0.12(mol)
硫粉過量。反應(yīng)1h后過濾,其目的是除去過量的硫粉。
(3)由于Na2SO3不穩(wěn)定,在敞開容器中于100℃溶液中保持沸騰下反應(yīng)長達(dá)1h,很容易被空氣氧化成Na2SO4。

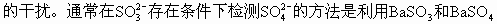
都不溶于水,但BaSO3溶于酸而BaSO4不溶于酸,加稀HCl即可檢測出。
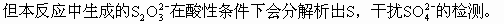
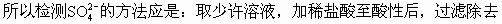
S,再加BaCl2溶液。
(4)(解法一)計算生成的Na2S2O3在70℃時飽和溶液應(yīng)有的體積,將它跟題設(shè)30mL相比較。
若反應(yīng)得到的Na2S2O3在70℃時配成飽和溶液,其體積為x,則
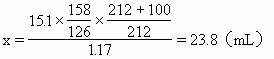
因23.8mL<30mL所以蒸發(fā)后的溶液尚未達(dá)到飽和。
(解法二)計算70℃時30mL飽和溶液中應(yīng)含Na2S2O3的質(zhì)量,將它跟反應(yīng)得到的Na2S2O3的質(zhì)量相比較。
若該溶液是飽和溶液,其所含Na2S2O3的質(zhì)量為x,則
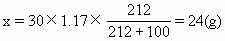
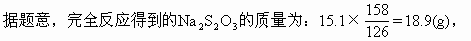
18.9g<24g,溶液尚未達(dá)到飽和。
(5)前題中已知生成的Na2S2O3的質(zhì)量為18.9g,如果要求得10℃時30mL溶液所析出的Na2S2O3·5H2O的質(zhì)量,還應(yīng)該知道溶液中水的質(zhì)量,而溶液中水的質(zhì)量=溶液質(zhì)量-Na2S2O3的質(zhì)量,溶液的質(zhì)量=溶液的體積(30mL)×溶液的密度。因此,還需要知道100℃時溶液的密度,應(yīng)選B項。
(6)設(shè)反應(yīng)得到的Na2S2O3·5H2O的質(zhì)量為x,則x中Na2S2O3
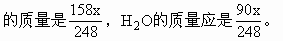
溶液中水的質(zhì)量=30×1.14-18.9=15.3(g)
根據(jù)10℃時的溶解度,析出晶體后的溶液一定是飽和溶液,則有

解得:x=23.2(g)
三、練習(xí)與檢測
1.t℃時,Na2CO3的溶解度為Ag,現(xiàn)有飽和Na2CO3溶液(100+A)g,其溶質(zhì)的質(zhì)量分?jǐn)?shù)為a%,向溶液中投入無水Na2CO3固體Ag,靜置后析出少量晶體(Na2CO3·10H2O),加水使晶體全部溶解,所得溶液仍為飽和溶液,加入的水是[]
A.100gB.(100+A)g

2.有X、Y、Z三種鹽,已知:
(1)25℃時,X飽和溶液其溶質(zhì)質(zhì)量分?jǐn)?shù)為15%;
(2)25℃時,在100g質(zhì)量分?jǐn)?shù)為10%的Y溶液中加入5gY(無水鹽)后,恰好達(dá)到飽和;
(3)25℃時,將一定量Z溶液蒸發(fā)掉5.75g水再恢復(fù)到25℃,或保持在25℃向其中加入6.3gZ的結(jié)晶水合物(Z·9H2O,摩爾質(zhì)量=240),都恰好形成飽和溶液。
則25℃時,X、Y、Z的溶解度(指無水鹽)大小順序正確的是[]
A.X>Y>ZB.Z>Y>X
C.Y>Z>XD.Z>X>Y
3.取50mL2mol/L的硫酸溶液,跟6.5g金屬鋅充分反應(yīng),加熱蒸發(fā)16.2g水,并冷卻至10℃時,可析出ZnSO4·7H2O多少克(10℃時ZnSO4溶解度為32g,硫酸密度1.12g/cm3)?
4.A、B兩種化合物的溶解度曲線如下圖所示,現(xiàn)要用結(jié)晶法從A、B混合物中提取A(不考慮A、B共存時,對各自溶解度的影響)
(1)取50g混合物,將它溶于100g熱水,然后冷卻至20℃。若要使A析出而B不析出,則混合物中B的質(zhì)量分?jǐn)?shù)(B%)最高不能超過多少?(寫出推理及計算過程)
(2)取Wg混合物,將它溶于100g熱水,然后冷卻至10℃。若仍要使A析出而B不析出,請寫出在下列兩種情況下,混合物中A的質(zhì)量分?jǐn)?shù)(A%)應(yīng)滿足什么關(guān)系式?(以W、a、b表示,只需將答案填寫在下列橫線的空白處。)
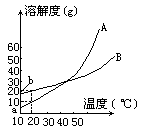
當(dāng)w<a+b時____
當(dāng)w>a+b時____
5.常溫下A和B兩種氣體組成混合物氣體(A的相對分子質(zhì)量大于B的相對分子質(zhì)量),經(jīng)分析,混合氣體中只含有氮和氫兩種元素;而且,不論A和B以何種比例混合,氮和氫的質(zhì)量比總大于14/3。由此可確定A為____,B為____。其理由是____。若上述混合氣體中氮和氫的質(zhì)量比為7∶1,則在混合氣體中A和B的物質(zhì)的量之比為____;A在混合氣體中的體積分?jǐn)?shù)為____%。
簡單答案
1.A;2.D;3.15.5g;
4.(1)在20℃時,若要B不析出,該溶液中B的質(zhì)量不能超過20g,由于A、B質(zhì)量共50g,所以這時A的質(zhì)量超過30g,大于它的溶解度,A析出,符合題意。即50g×B%≤20g,B%≤40%。
(2)當(dāng)W<a+b時,A%>a/w;當(dāng)W>a+b時,A%≥W-b/W;
5.NH3N2純NH3氣體中氮和氫的質(zhì)量比為14/3,在純NH3中混入任何比例的N2都將使氮和氫的質(zhì)量比大于14/34∶180%。
歡迎使用手機(jī)、平板等移動設(shè)備訪問中考網(wǎng),2024中考一路陪伴同行!>>點(diǎn)擊查看









