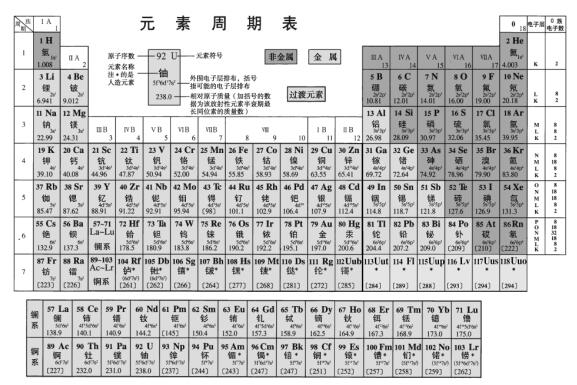
世間萬物都是由元素組成的,不管是氧分子中的氧原子還是水分子中的氧原子,都是氧元素的原子。元素是同一類原子(核電荷數(shù)相同的原子)的總稱。不同元素的原子不同,到目前為止,人們在自然界中發(fā)現(xiàn)的元素有90余種,人工合成的元素有20余種,都收錄在我們課本附錄的元素周期表中。元素符號是學習和研究化學的人都應該認識的符號,元素符號除了表示一種元素外,也可表示這種元素的一個原子,如Cl除表示氯元素,還表示一個氯原子。
在元素符號右上角標出離子所帶正、負電荷數(shù)后就成為離子符號。例如“Na+”就表示鈉原子失去一個電子后成為帶一個單位正電荷的鈉離子,“ Mg2+”表示鎂原子失去兩個電子后成為帶兩個單位的鎂離子,“O2-”表示氧原子獲得兩個電子后成為帶兩個單位負電荷的氧離子。
1869年以前,科學家已經陸續(xù)發(fā)現(xiàn)了63種元素,這些元素之間似乎沒有任何聯(lián)系,好像互不相干。
俄國科學家門捷列夫(Dmitry Ivanovich Mendeleev,1834~1907)在前人工作的基礎上,對元素及其性質進行了系統(tǒng)的研究,他將當時已知的63種元素依據(jù)相對原子質量大小規(guī)律進行排列,制成的表格成為現(xiàn)代元素周期表的雛形。利用周期表,門捷列夫成功預測了當時尚未發(fā)現(xiàn)的元素(鎵、鈧、鍺)。
1913年英國科學家莫色勒利用陰極射線撞擊金屬產生X射線,發(fā)現(xiàn)原子序數(shù)越大,X射線的頻率就越高,因此他認為核的正電荷數(shù)決定了元素的化學性質,并把元素依照核內正電荷數(shù)(即質子數(shù))排列,經過多年修訂后才成為當代的周期表。
隨著人們對元素地進一步認識,元素周期表得到了完善,現(xiàn)在元素周期表已經成為人們研究化學、研究物質的一個必備的工具。
在化學學科領域中使用的元素周期表提供的信息更突出了元素的原子結構信息。
元素周期表中現(xiàn)收錄112種元素。元素有多種分類方式,按組成單質性質的不同可以分為金屬元素和非金屬元素。如鈉、鎂、鋁等是金屬元素,一般用“钅”作偏旁;而碳、氧、溴等為非金屬元素,一般以“石”、“氣”、“氵”作偏旁。從元素的偏旁不但可以看出是金屬元素還是非金屬元素,還可以看出這些元素的單質在常溫常壓下的狀態(tài),一般以“石”為偏旁的單質在常溫常壓下為固體,以“氣”為偏旁的單質為氣體,而以“氵”為偏旁的單質為液體,從這些意義上看,元素的中文名稱比元素符號多出更多的涵義,這全要歸功于科學家徐壽。
資料卡片 徐壽(1818.2.26~1884.9.24)字雪邨,號生元,是我國近代化學的啟蒙者,19世紀60年代,在我國系統(tǒng)介紹了近代化學的基礎知識。在徐壽生活的年代,我國不僅沒有外文字典,甚至連阿拉伯數(shù)字也沒有,要把西方科學技術的術語用中文表達出來是項開創(chuàng)性的工作,做起來實在是困難重重。西方的拼音文字和我國的方塊漢字,在造字原則上有極大不同,幾乎全部的化學術語和大部分化學元素的名稱,在漢字里沒有現(xiàn)成的名稱,這可能是徐壽在譯書中遇到的最大困難,為此徐壽花費了不少心血。對金、銀、銅、鐵、錫、硫、碳及養(yǎng)氣(今譯氧氣)、輕氣(今譯氫氣)、綠氣(今譯氯氣)、淡氣(今譯氮氣)等大家已較熟悉的元素,他沿用前制,根據(jù)它們的主要性質來命名。對于其他元素,徐壽巧妙地應用了取西文第一音節(jié)而造新字的原則來命名,例如鈉、鉀、鈣、鎳等。徐壽采用的這種命名方法,后來被我國化學界接受,一直沿用至今。
通常我們還可以根據(jù)元素含量的多少,把元素分為常量元素和微量元素;根據(jù)元素的來源,可以分為自然界中存在的元素和人工合成的元素;根據(jù)元素原子是否具有放射性,分為放射性元素和非放射性元素等等。
一種元素可以存在于不同的物質中,如水、二氧化碳、生石灰、石灰石中都存在氧元素,而氧氣、臭氧也是由氧元素組成的,在前一類物質中氧都和其他元素共存,也就是存在于化合物中;后一類物質中只存在氧一種元素,也就是存在于單質中。通常,我們把化合物中元素的狀態(tài)稱為化合態(tài),把單質中的元素狀態(tài)稱為游離態(tài),絕大部分元素在自然界中都有兩種存在形態(tài),有些元素在自然界中只存在化合態(tài),沒有游離態(tài),如鈉元素主要以Na2CO3、NaCl等化合物的形式存在,在自然界中沒有單質鈉。食鹽中的氯元素,也是只有化合態(tài)沒有游離態(tài),因為氯氣性質過于活潑,無法在自然條件下和其他物質和諧相處。
一般來說,金屬元素具有金屬性,非金屬元素具有非金屬性,位于周期表中金屬與非金屬交界處的元素,往往既有金屬性又有非金屬性。所謂元素金屬性,通俗的講,就是其單質一般有金屬光澤、良好的導電性、導熱性和延展性等物理通性;而其原子在化學變化中,一般具有失去電子的傾向。
[想一想] 1.畫出鈉、鎂的原子結構示意圖。有人認為鎂原子能失去2個電子,而鈉原子只能失去1個電子,所以鎂的金屬性比鈉強,你同意這種觀點嗎?
事實上金屬元素原子的最外層電子數(shù)一般都較少(≤3),為了達到類似稀有氣體的相對穩(wěn)定結構,它們往往都會選擇失去最外層電子,元素的這種性質就是所謂的金屬性。不同元素的原子失去最外層電子的能力不同,越容易失去最外層電子的金屬,其元素的金屬性就越強,對應的金屬單質也就越活潑。如金屬活動順序表中K排在Na的前面,就意味著K比Na活潑,K比Na容易失去最外層電子,鉀元素的金屬性就比鈉元素的金屬性強。
[想一想] 2.畫出氧、硫的原子結構示意圖,從結構上說明氧元素非金屬性比硫元素強的原因。
非金屬元素的原子最外層電子數(shù)一般都較多(≥4),為了達到類似稀有氣體的相對穩(wěn)定結構,它們往往都會選擇得到電子,元素的這種性質就是所謂的非金屬性。不同非金屬元素的原子得電子能力不同,越容易得到電子的非金屬,元素的非金屬性就越強,對應的非金屬單質也就越活潑。如F的非金屬性比Cl強,F(xiàn)原子比Cl原子容易得到電子,氟氣比氯氣更活潑,一般條件下,我們很難制備并保存氟氣。
元素的金屬性和非金屬性也可以以化合價體現(xiàn)。當元素處于游離態(tài)時其化合價為零,當元素處于化合態(tài)時其化合價就有正、負之分。化合物中標定元素的化合價要遵循以下原則:
(1)化合物中元素的正負化合價總數(shù)相等。這是確定化合價的最基本的原則,在化合物MnO2中,O元素呈現(xiàn)-2價,根據(jù)守恒原則可確定多價態(tài)金屬Mn呈現(xiàn)+4價。
(2)金屬無負價(在化合物中都呈現(xiàn)正價),鈉、鎂、鋁等常見金屬的價態(tài)是唯一的。在化合物AlN中,我們知道Al只有+3價,則很容易推出N呈現(xiàn)-3價;在化合物NaH中,Na呈現(xiàn)+1價,則H為-1價;在化合物Na2O2中,Na呈現(xiàn)+1價,則O為-1價。
(3)兩種非金屬元素化合時非金屬性強的顯示負價。雖然我們現(xiàn)在還不會去比較非金屬性的強弱,但在所有非金屬氫化物中H都呈現(xiàn)+1價,而氧化物中O都呈現(xiàn)負價,知道這些有利于標定各種化合物中元素價態(tài),例如:化合物NH3中,H呈現(xiàn)+1價,則N呈現(xiàn)-3價;化合物SiO2中,O呈現(xiàn)-2價,則Si為+4價。
(4)常見元素的最高價不高于其原子的最外層電子數(shù),最低價不低于最外層電子數(shù)-8。
掌握這個原則,就不會出現(xiàn)亂標價態(tài)的現(xiàn)象。如S原子最外層有6個電子,所以S最高為+6價,最低為-2價,在化合物Cu2S中,若Cu為+2價,則S體現(xiàn)-4價,就與事實不符,所以Cu就只能為+1價,而S體現(xiàn)-2價。
[試一試] 請標出下列物質中加著重號的元素的化合價。
NH3、H2SO3、K2CrO4、KMnO4、FeS、Cu2O、
KClO3、NH4NO3、Na3N、HClO、H2O2、P4、
MgSO4、NaAlO2、CaH2。
遵循先簡單后復雜的基本思想,一般先標定只有單一化合價的元素,化合價種類越多的元素越在后標定。在復雜化合物中標定化合價的基本順序為單一價態(tài)金屬(K、Ca、Na、Mg、Al、Zn等)→H→O→其他非金屬或多價態(tài)金屬。對于不含單一價態(tài)金屬,也不含H和O的化合物,一般都要依據(jù)規(guī)則(4)解決問題。化合物FeS2中,若Fe呈+3價,則S為-1.5價,一般元素價態(tài)無小數(shù),不成立;若Fe呈+2價,
則S顯-1價。化合物Na2FeO4中,先Na后O再Fe,Na為+1價,O為-2價,根據(jù)化合價代數(shù)和為0可求得Fe為+6價。
新初三快掃碼關注
中考網微信公眾號
每日推送學習技巧,學科知識點
助你迎接2020年中考!
歡迎使用手機、平板等移動設備訪問中考網,2024中考一路陪伴同行!>>點擊查看