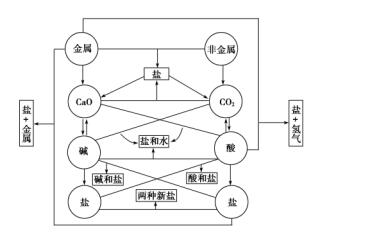
初中化學所涉及的元素化合物知識主要包括以O2、H2、C、S、P等為代表的非金屬單質,以Fe、Cu、Na為代表的金屬單質,以CO、CO2等為代表的非金屬氧化物,以Fe2O3、CuO等為代表的金屬氧化物,以H2SO4、HNO3、HCl為代表的酸,以NaOH、Ca(OH)2為代表的堿,以NaCl、CuSO4、Na2CO3、CaCO3為代表的鹽。這些物質之間的相互轉化關系可用下圖描述。
在初中化學中,通常把常見無機物分成單質、氧化物、酸、堿和鹽等五大類。從結構和性質角度來分析,把無機物分成以下幾類可能更合理些:①金屬(包括游離的金屬單質和合金),②非金屬(非金屬單質),③堿性物質(包括堿性氧化物和堿,基本上都是離子化合物),④酸性物質(包括酸性氧化物和酸,基本上都是共價化合物),⑤鹽(都可以看成是堿性物質和酸性物質的反應產物)。
同一類物質一般有相似的性質,由于無機物種類不多,所以貌似復雜紛繁的無機化學反應,大多數可以歸納到以下三大類反應。
①酸性物質和堿性物質之間的反應 性質對立的這兩類物質,一般都能反應,反應生成鹽或鹽和水。
②酸、堿、鹽等電解質在溶液里的反應 反應過程中一般有水、沉淀和氣體生成。
③氧化還原反應 在結構上容易得電子的物質和容易失電子的物質之間的化學反應。
初中化學中,沒有單質參加的反應大部分屬于前兩類化學反應,但都是以個別反應為示例,未形成一般性規律,使我們無法用來分析高中階段所接觸物質的基本性質。而反應物涉及單質的反應大多數為氧化還原反應,但反應本質的理解也不作為要求,氧化還原反應規律正是高中階段接觸的最重要的化學反應規律。
下面,我們將著重補充有關前兩類反應的基本規律,以幫助我們更好地理解必修1中常見無機物的化學性質。
1.酸性物質和堿性物質的反應
(1)酸性物質和堿性物質
堿性物質包括堿和對應的堿性氧化物,除氨水外,結構上都可看成是由金屬陽離子和OH-或O2-構成,狀態上一般都是不揮發性固體。
酸性物質包括酸和酸性氧化物,酸又可分為無氧酸(如鹽酸HCl、氫氟酸HF、氫硫酸H2S、氫氰酸HCN等)和含氧酸(如H2SO4、HNO3、H2CO3、H3PO4、高錳酸HMnO4、次氯酸HClO),無機含氧酸都是酸性氧化物的水化物;酸性氧化物又可分為非金屬氧化物和金屬氧化物(如CrO3、Mn2O7等)。酸性物質在結構上一般都是由分子構成(少量的直接以原子構成,如B2O3、SiO2),在水分子作用下,酸分子可被離解成氫離子和其他陰離子;酸性氧化物在水中并不會被直接離解成陰陽離子,但部分酸性氧化物會與水化合形成酸。中學階段,大多數非金屬酸性氧化物都是氣體(P2O5、B2O3、SiO2是固體),而金屬酸性氧化物大多是固體。
(2)酸性物質和堿性物質的反應
酸性物質和堿性物質之間可發生以下四種反應類型:
酸性氧化物+堿性氧化物===含氧酸鹽
酸性氧化物+堿===鹽+水
堿性氧化物+酸===鹽+水
酸+堿===鹽+水
從中可以看出,當反應物中只有氧化物時,生成物只有鹽;而反應物中有酸或堿時,生成物是鹽和水。
酸性物質跟堿性物質,兩者的性質對立越強烈,也就是反應物間酸堿性差異越大,反應越容易發生。弱酸性物質和弱堿性物質,往往較難發生反應,如碳酸和氫氧化鐵就不發生反應。
①酸性氧化物和堿性氧化物生成含氧酸鹽
酸堿性對立越強烈,兩種氧化物間反應生成含氧酸鹽就越容易發生,反過來,生成的含氧酸鹽就越穩定,越難分解。參加反應的兩種氧化物中,如果有一種是強酸性或強堿性的,反應往往都能進行。
Na2O+CO2===Na2CO3(Na2O是堿性較強的物質,對應水化物為燒堿)
CaO+CO2===CaCO3(CaO是堿性較強的物質,對應水化物為熟石灰)
CuO+SO3===CuSO4(SO3酸性較強,對應水化物為硫酸)
如果兩種氧化物的酸、堿性都不強,它們一般不能發生反應,例如氧化銅跟二氧化碳就不能直接化合。
在這種反應類型中,人們還發現,極難揮發的酸性氧化物(如P2O5、B2O3、SiO2,其中SiO2熔點高達1 700 ℃左右,極高溫度下也不揮發)跟堿性氧化物混合強熱時能化合生成對應鹽。如鋼鐵冶煉中的高溫造渣反應,本質是SiO2和各種金屬氧化物的反應。
CaO+SiO2===CaSiO3 FeO+SiO2===FeSiO3
②堿性氧化物和酸的反應
堿性氧化物和酸的性質對立越強烈,反應越容易。不溶性堿性氧化物(對應水化物往往是弱堿,堿性較弱)一般不能跟極弱的酸(如碳酸、次氯酸HClO)反應。
堿性氧化物遇酸時,結構中的氧離子跟H+結合生成水,金屬陽離子和酸根離子結合成鹽。強酸能跟所有堿性氧化物反應,工業生產中常利用酸除去金屬表面的氧化物銹斑,例如:
Fe2O3+6HCl===2FeCl3+3H2O
CuO+H2SO4===CuSO4+H2O
醋酸這類較強的弱酸,也幾乎能跟所有堿性氧化物反應,如:
Fe2O3+6CH3COOH===2(CH3COO)3Fe+3H2O
③酸性氧化物和堿的反應
酸性氧化物跟堿反應,一般生成鹽和水。反應在溶液中進行時,可以看成酸性氧化物先跟水反應變成酸,酸再和堿反應生成鹽和水。如:
2NaOH+CO2===Na2CO3+H2O(Na2CO3讀作碳酸鈉)
2NaOH+SO2===Na2SO3+H2O(Na2SO3讀作亞硫酸鈉)
兩者性質對立越強,反應越容易,不溶性氫氧化物(大多為弱堿)一般不跟極弱的酸性氧化物(如CO2、SiO2)反應,像SiO2這種極弱的不溶性酸性氧化物跟強堿作用時反應也很慢,與強堿共熔時才有很好的反應,如硅酸鈉、硅酸鉀等鹽常利用二氧化硅跟強堿共熔制備,硅酸鈉、硅酸鉀的水溶液有很強的粘性,俗稱水玻璃,是常用的無機礦物膠。
2NaOH+SiO2強熱(=====)Na2SiO3+H2O
2KOH+SiO2強熱(=====)K2SiO3+H2O
其實,堿和酸性氧化物要生成鹽和水,堿必須相對過量,酸性氧化物少量。如果反應中酸性氧化物過量,而堿不足時就只能生成酸式鹽,如
NaOH+CO2===NaHCO3(NaHCO3讀作碳酸氫鈉)
NaOH+SO2===NaHSO3(NaHSO3讀作亞硫酸氫鈉)
[試一試] 1.寫出氨水(NH3·H2O)和CO2生成正鹽和酸式鹽的兩種化學反應方程式。
由此可見,酸性氧化物和堿反應生成物與其相對量有關,相對量不同,生成的鹽也不同,導致基于此類反應的有關實驗制備、化學計算更趨復雜。
④酸跟堿的反應
酸跟堿的反應,本質上是酸組成中的H+與堿組成中的OH-結合成水,金屬陽離子(或銨根離子)與酸根離子結合成鹽。酸和堿生成鹽和水的反應,又稱為中和反應,它是最典型的復分解反應之一。
NaOH+HCl===NaCl+H2O
NaOH+HClO===NaClO+H2O(HClO讀次氯酸,為弱酸)
NaOH+CH3COOH===CH3COONa+H2O
NaOH+HNO2===NaNO2+H2O(HNO2讀亞硝酸,為弱酸)
2NaOH+H2SO4===Na2SO4+2H2O
酸和堿的性質對立越強,反應越容易,一般只有極弱的酸跟極弱的堿之間才不會反應,其他酸和堿一般都能反應,例如不溶性氫氧化物一般不溶于碳酸、硅酸等極弱的酸溶液。
2.酸、堿、鹽等電解質在溶液里的反應
堿、酸和鹽在水溶液里全部或部分電離成離子,都是電解質,在溶液里可兩兩反應。其中酸和堿的反應稱為中和反應,生成水是相互間反應的基本條件。另外,酸和鹽、堿和鹽也能發生反應,其反應規律分別如下。
(1)酸和鹽的反應
在中學階段,我們所接觸的酸以可溶性酸為主,溶質在水中電離成氫離子和酸根離子,當向其中加入鹽時,只要其中任何一種離子的濃度能降低,鹽和酸的反應就能發生。
在鹽酸中加入碳酸鈉固體,因為碳酸鈉在水中可電離出碳酸根離子,它和H+能快速結合成不穩定的碳酸,分解成CO2和水,導致該反應發生。同樣,加入碳酸鈣或碳酸鋇固體時,雖然固體溶解度不大,但溶解部分電離產生的碳酸根仍能和H+結合,所以照樣可以反應,不過相同條件下產生氣泡不如碳酸鈉劇烈。其反應方程式如下:
Na2CO3+2HCl===2NaCl+CO2↑+H2O
BaCO3+2HCl===BaCl2+CO2↑+H2O
在硫酸中加入醋酸鈉固體時,醋酸鈉在水中可電離出醋酸根離子,它和H+結合形成醋酸(一種弱酸,水溶液中主要以分子形態存在),這將大大降低了H+濃度,促成反應進行到底。次氯酸鈉、磷酸鈉等弱酸鹽和硫酸、鹽酸等強酸的反應原理與此相似,習慣上被初中化學教師概括為強酸制弱酸。反應方程式如下:
2CH3COONa+H2SO4===Na2SO4+2CH3COOH
2NaClO+H2SO4===Na2SO4+2HClO
[試一試] 2.一定條件下,稀硫酸和氯化鋇溶液,氯化鈉與硝酸銀溶液混合都有白色沉淀生成,寫出反應方程式,說明反應充分進行的理由。
向硫酸銅溶液中,滴入新制的飽和氫硫酸(H2S、二元弱酸)時,能觀察到黑色沉淀,表明二者能發生化學反應,其反應方程式如下:
CuSO4+H2S===H2SO4+CuS ↓
該反應的發生證明,弱酸在一定條件下也可生成強酸,所以“強酸制備弱酸”規律是有缺陷的、不嚴密的、有條件的。從本質上看,硫酸銅電離產生的Cu2+能和氫硫酸部分電離產生的S2-形成難溶于水(也難溶于酸)的CuS沉淀,銅離子濃度降低,反應能夠發生。從表面看,這一反應發生的理由仍然是因為生成物出現了不溶性沉淀物,降低了離子濃度。
(2)堿和鹽的反應
一定條件下,在氯化鐵溶液中滴加氫氧化鈉溶液可以產生紅褐色沉淀,該反應往往被用來驗證溶液中是否存在鐵離子,其反應方程式是FeCl3+3NaOH===Fe(OH)3↓+3NaCl。工業生產中,通過向氫氧化鈣懸濁液中加入飽和碳酸鈉溶液制備燒堿,其反應方程式是Na2CO3+Ca(OH)2===CaCO3↓+2NaOH。向氯化銨稀溶液中加入燒堿固體,能放出有刺激性氣味的氨氣,這是銨鹽的一個重要性質,其反應方程式是NH4Cl+NaOH===NaCl+NH3↑+H2O。
一般來說,鹽和堿的反應中,兩種反應物都是可溶性化合物,如果都不溶解,反應將很難進行。
(3)鹽和鹽的反應
酸和酸、堿和堿、鹽和鹽理論上也可能發生反應,酸和酸、堿和堿的反應,反應原理復雜,在高中化學中會逐步接觸個別案例;而鹽與鹽的反應在初中化學中已有接觸,在高中會增加更多案例。
如我們熟知的硝酸銀與氯化鈉的反應,被用來檢驗溶液中是否存在氯離子;氯化鋇和硫酸鈉的反應,被用來檢驗溶液中是否存在硫酸根離子;碳酸鈉和氯化鋇溶液混合時也會產生白色沉淀。目前所接觸的案例中,大多數鹽和鹽的反應均發生在兩種可溶性鹽之間,在高中選修“化學反應原理”模塊,會學習不溶性鹽和另一種可溶性鹽溶液之間的反應,如分析化學中常用飽和碳酸鈉溶液處理硫酸鋇固體,將不溶于水的硫酸鋇轉化為可溶于酸的碳酸鋇,這種反應方式常被用于無機化合物的制備、提純和廢水處理中。
以上發生在溶液中的兩種化合物間的反應,如堿性氧化物和酸、酸和堿、酸和鹽、堿和鹽、鹽和鹽的反應,都是兩種電解質之間的反應,兩種化合物先“分解”成兩種成分(陽離子和陰離子),再重組為兩種新的化合物,這類反應習慣上稱為復分解反應。理論上,任何兩種電解質,只要彼此組分中的陰陽離子都不相同,相互交換組成又能形成沉淀(溶解度更小的物質)、氣體(揮發性物質)、水(高中化學將此擴展為水、醋酸等弱電解質)等產物,就有可能發生復分解反應。從形式上看,形成沉淀、氣體或水是復分解反應發生的三種主要原因;從本質上看都是通過降低原反應物中某種離子的濃度而實現的。
3.氧化物跟其對應水化物間的相互轉化
含氧酸和堿分別是酸性氧化物和堿性氧化物的水化物(和水化合形成產物的簡稱),它們之間往往有如下轉換關系:
堿性氧化物+水―→堿
酸性氧化物+水―→酸
下面綜合討論氧化物與其水化物間的轉化規律。
(1)堿性氧化物和堿之間的相互轉化
大部分堿性氧化物不能跟水直接化合成對應的水化物,一般來說,只有可溶性堿才可以此堿性氧化物和水直接化合形成,中強堿氫氧化鎂也適用此規律,但化合速率不如可溶性的燒堿。例如:
Na2O+H2O===2NaOH
MgO+H2O===Mg(OH)2
堿性氧化物跟水接觸時,在水分子作用下,晶體中的金屬離子和氧離子被水分子入侵后離解成自由移動的離子,其中的氧離子被水中微量的H+捕獲成為OH-,這樣就使氧化物轉變成堿。
堿在加熱時一般可分解為堿性氧化物和水,其分解傾向與堿性氧化物和水結合傾向的強弱相反。一般地說,越容易由堿性氧化物和水化合生成的堿就越難分解,也就是說,可溶性堿一般加熱不分解,而不溶性堿加熱時可分解成堿性氧化物和水。強堿類的氫氧化鈣要強熱才分解,中強堿的氫氧化鎂在加熱時可分解,氫氧化銅在熱水中就可分解成黑色沉淀,而氫氧化銀極不穩定,在含Ag+的溶液中加入堿,析出的氫氧化物馬上分解成氧化物,只能得到氧化物(Cu+、Hg2+與Ag+類似)。
Ca(OH)2強熱(=====)CaO+H2O
Mg(OH)2加熱(=====)MgO+H2O
Cu(OH)2熱水(=====)CuO+H2O
總之,一般可溶性堿可由其氧化物和水化合形成,高溫也難分解;不溶性堿不能由其氧化物與水化合形成,但受熱會分解成對應氧化物和水。
(2)酸性氧化物和酸之間的相互轉化
一般來說,可溶于水的酸性氧化物都能和水直接化合成對應的含氧酸(元素有相同的價態)。例如:
SO3+H2O===H2SO4
SO2+H2O===H2SO3
而不溶性氧化物(如SiO2,沙子、石英、水晶的主要成分)一般和水就不能直接化合,因此對應含氧酸H2SiO3就只能用其他方法合成。二氧化鈦(TiO2)、三氧化鎢(WO3)等酸性氧化物不能和水化合的原因與此相似。制取二氧化硅可以和氧化鈉或氫氧化鈉反應得到硅酸鈉,硅酸鈉再和鹽酸、稀硫酸等酸發生反應轉化為硅酸,即SiO2→Na2SiO3→H2SiO3兩步完成轉化。
[試一試] 3.以SiO2和其他常見試劑為原料,制取硅酸,寫出相應的化學反應方程式。
絕大部分含氧酸能分解成對應的氧化物(被形象地稱為酸酐)和水。對應酸酐不揮發、不溶解(難溶或微溶)的,容易受熱分解成酸酐和水,如硅酸、磷酸;對應酸酐為低價態氣體的,只能存在于溶液中,也就是極易分解,如碳酸、亞硫酸。
H2SiO3△(=====)SiO2+H2O
H2SO3=====SO2+H2O
[試一試] 4.HNO2也只能在稀溶液中存在,已知亞硝酸鈉溶液和硫酸可以發生復分解反應,請寫出相應的化學反應方程式。
新初三快掃碼關注
中考網微信公眾號
每日推送學習技巧,學科知識點
助你迎接2020年中考!
歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看