來源:網絡資源 2022-10-16 11:52:44
自然界的水(人類擁有的水資源)
(1)世界水資源概況
地球表面約71%被水覆蓋,海洋是地球上最大的儲水庫,其儲水量約占全球總儲水量的96.5%。
淡水約占全球總儲水量的2.53%。
海水中含有的化學元素有80多種。
(2)我國的水資源概況
❤我國水資源總量居世界第六位。
❤我國人均水量約為世界人均水量的四分之一。
愛護水資源
(1)節約用水
❤工業上,提高水的重復率;農業上,農業和園林澆灌改大水漫灌為噴灌和滴灌;
❤生活中,如關緊身邊的水龍頭,更換滴水、漏水的水龍頭,生活用水重復使用,如用淘米水澆花。
(2)水體污染的來源:工業污染、農業污染、生活污染。
❤工業污染:廢水、廢渣、廢氣(工業“三廢”)。
❤農業污染:化肥、農藥的不合理使用。
❤生活污染:含磷洗滌劑的大量使用、生活污水的任意排放等。
(3)防水體污染
❤工業上,應用新技術、新工藝減少污染物的產生,同時對污染的水體處理符合標準后再排放;
❤農業上,提倡使用農家肥,合理使用化肥和農藥;
❤生活污水要逐步實現集中處理和排放。
❤加強水質的質量檢測
水的凈化(過濾、吸附、蒸餾)
(1)純水和天然水
❤純水是無色、無臭、清澈透明的——純凈物
❤而自然界中的河水、湖水、井水等天然水里由于含有許多可溶性和不溶性雜質,因此常呈渾濁。——混合物
(2)自來水廠凈水過程
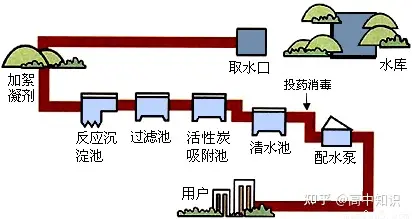
取——從水庫中取水
加——加絮凝劑(明礬),使懸浮的顆粒狀雜質被吸附凝聚。
沉——在反應沉淀池中沉降分離,使水澄清。
濾——將沉淀池中流出的較澄清的水通入過濾池中,進一步除去不溶性雜質
吸——再將水引入活性炭吸附池,除去水中臭味和殘留的顆粒較小的不溶性雜質
投——投藥消毒(通常通入氯氣的方法)除去細菌,殺菌后的水就是可以飲用的自來水,通過配水泵供給用戶。但水中仍然含有可以溶于水的一些雜質,所以還是混合物。【它是一個化學變化過程,因為除去病菌的過程,就是把病菌變成其他物質的過程。】
(3)常用的凈水方法
Ⅰ.沉淀——除去不溶性雜質
使不溶性的沉淀沉降下來,并與水分層。
Ⅱ.過濾——除去不溶性雜質
把液體與不溶于該液體的固體分開。

1)操作步驟:
①取渾濁的天然水,加入3鑰匙明礬粉末,攪拌溶解后,靜置。
②準備過濾器,圓形濾紙,三層濾紙,折好后放入漏斗,使之緊貼漏斗壁。
2)操作要點:“一貼二低三靠”:
一貼:濾紙緊貼漏斗的內壁;用少量水浸潤濾紙并使得濾紙與漏斗之間不要有氣泡。
二低:過濾時濾紙的邊緣應低于漏斗的邊緣;漏斗內液體的液面低于濾紙的邊緣。
三靠:傾倒液體的燒杯嘴緊靠引流的玻璃棒;玻璃棒的末端輕輕靠在三層濾紙的一邊;漏斗下端緊靠燒杯內壁。
3)濾液仍然渾濁的可能原因:濾紙破損;液面超過濾紙邊緣;漏斗或燒杯不干凈。
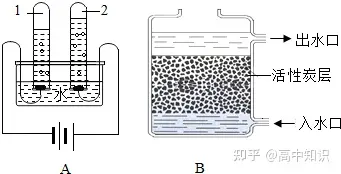
Ⅲ.吸附——除去部分不溶性雜質、可溶性雜質、臭味、色素等。
利用活性炭等具有吸附作用的物質把水中的一些不溶性雜質、部分可溶性雜質吸附在表面而除去。
Ⅳ.蒸餾——除去可溶性雜質和不溶性雜質.
通過加熱的方法使水變成水蒸氣后冷凝成水。

實驗步驟:
1)在燒瓶中加入1/3體積的硬水,再加入幾粒沸石或碎瓷片,使各連接部位嚴密不漏氣。
2)連接好裝置,使各部分嚴密不漏氣,加熱燒瓶,注意不要使液態沸騰得太劇烈,以防止液體通過導管之間流到試管里。
3)棄去開始蒸餾出的部分液態,收集到10ml左右蒸餾水后,停止加熱,用肥皂水比較蒸餾前后的硬度變化。
注意事項:
1)蒸餾燒瓶中的液體不能超過其球部容積的2/3,也不能少于1/3;
2)加熱時不得將液體全部蒸干;
3)冷卻水的方向是下進上出,即“下口進水,上口出水”;(冷卻水的流向與蒸氣的流向相反,這種逆流冷卻可以達到最好的冷卻效果。)
4)溫度計的水銀球的上緣要恰好與蒸餾燒瓶支管口的下緣在同一水平線上;
5)加幾塊碎瓷片或沸石可以防止加熱時液體暴沸而劇烈跳動;
6)蒸餾燒瓶下面需墊上石棉網,以防炸裂蒸餾燒瓶;
7)開始收集到的液體因與某些器壁接觸可能會引入雜質,因而棄去。
【總結】
❤以上四種凈水方法(沉淀、過濾、吸附、蒸餾)均為物理方法。
❤用蒸餾方法得到的水為純凈物,其他三種方法得到的水均為混合物。
❤一般的凈水過程,通常都是幾種凈水方法綜合運用,這樣凈化水的效果更好。
硬水與軟水(鑒別、轉化)
(1)定義
硬水:含較多可溶性鈣、鎂化合物的水。
軟水:不含或含較少可溶性鈣、鎂化合物的水。
(2)鑒別硬水和軟水(鑒別蒸餾水和礦泉水):
把等量的肥皂水分別加入到盛有等量的軟水、硬水的燒杯中,攪拌。
軟水:產生大量泡沫,浮渣少;硬水:不產生泡沫或泡沫少,浮渣多;

(3)硬水給生活和生產帶來的危害
①用硬水洗滌衣服,既浪費肥皂也洗不凈衣服,時間長了還會使衣服變硬。
②鍋爐用水硬度高十分危險,因為鍋爐內結垢后不僅浪費燃料,而且會使鍋爐內管道局部過熱,易引起管道變形或損壞,嚴重時還可能引起爆炸。
(4)硬水的軟化
❤生活中降低水的硬度的方法:煮沸。
❤工業和科學實驗中軟化硬水的方法:蒸餾、離子交換法。
水的電解、水的宏觀組成與微觀構成兩級產物的性質及檢驗
(1)從氫氣燃燒探究水的組成
Ⅰ.氫氣的物理性質
無色無味的氣體,難溶于水,密度比空氣小。
Ⅱ.氫氣的驗純
操作:用拇指堵住集滿氫氣的試管口(注意試管口要朝下)。靠近火焰,移開拇指點火。
結論:發出尖銳爆鳴聲表明氫氣不純,聲音很小則表示氫氣較純。
混有一定量空氣或氧氣的氫氣與明火會發生爆炸。
點燃任何可燃性氣體(如氫氣、一氧化碳等)之前都要檢驗氣體的純度,以防止發生爆炸。
Ⅲ.氫氣的化學性質
H2:可燃性2H2+O2
![]()
2H2O(淡藍色火焰)
結論:氫氣在空氣中能燃燒,生成水,放出熱量;水中含有氫元素和氧元素。
Ⅳ.氫氣的用途
充灌探空氣球——密度最小的氣體。
作高能燃料——可燃性。
(2)水的電解實驗探究水的組成
Ⅰ.水的電解實驗
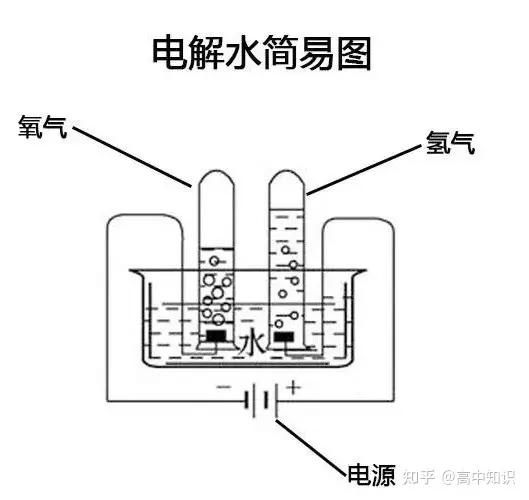
①實驗操作:往電解器玻璃管里注滿水,接通直流電源,觀察現象,經過一段時間后,停止通電。
②實驗現象:
❤通電一段時間后,看到兩個電極上都有氣泡產生。
❤與正極相連的試管內收集的氣體體積小,與負極相連的試管內收集的氣體體積大。前者與后者體積比約為1:2。
③氣體的檢驗:
正極:試管1中的氣體可使帶火星的木條復燃,說明是氧氣;
負極:將試管2中的氣體移近火焰時,氣體能夠燃燒,火焰呈淡藍色,如氣體量少,可能發出爆鳴聲,證明是氫氣。
④結論:
❤水在通電條件下,發生了分解反應,生成了氫氣和氧氣。
❤正極:氧氣;負極:氫氣;正極負極體積比:1:2
❤方程式:2H2O
![]()
2H2↑+O2↑
Ⅱ. 從微觀角度理解水的電解
當水分子分解時,生成了氧原子和氫原子,2個氫原子結合成1個氫分子,很多氫分子聚集成氫氣;2個氧原子結合成1個氧分子,很多氧分子聚集成氧氣。
Ⅲ.水的組成
宏觀:水是由氫元素、氧元素組成;微觀:水由大量水分子構成;1個水分子由2個氫原子和1個氧原子構成;
【拓展】鐵絲在氧氣中燃燒,集氣瓶底部放少量水的原因:防止熔融物濺落炸裂集氣瓶底部。
硫在氧氣中燃燒,集氣瓶底部放少量水的原因:吸收二氧化硫,防止污染空氣。
歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看