來源:網絡資源 2022-11-02 13:04:41
鈉及其化合物
一、鈉的物理性質
1.顏色:銀白色、有金屬光澤。
2.密度:鈉、水和煤油的密度大小為ρ(水)>ρ(鈉)>ρ(煤油)。
3.熔點:小于(填“大于”“小于”或“等于”)100 ℃。
4.硬度:質地較軟。
二、從原子結構認識鈉的化學性質——還原性

1.鈉與非金屬單質反應
(1)與O2反應
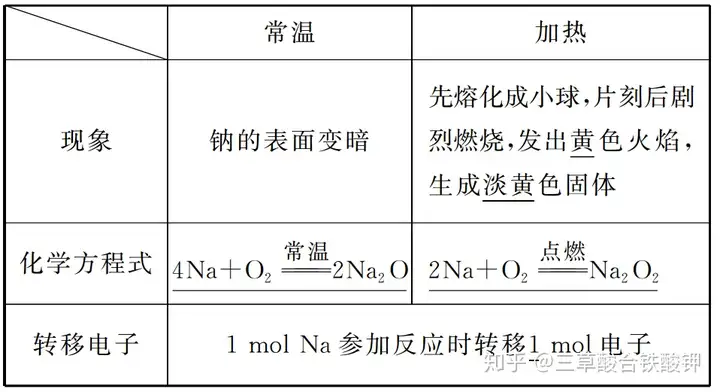
(2)與Cl2反應的化學方程式:2Na+Cl2點燃(=====)2NaCl。
(3)與S反應的化學方程式:2Na+S△(=====)Na2S。
2.鈉與水、鹽溶液的反應
(1)鈉與水的反應
①鈉與水反應的離子方程式:2Na+2H2O===2Na++2OH-+H2↑。
②鈉與水(含酚酞)反應的實驗現象及解釋:

(2)鈉與鹽溶液的反應
Na先和水反應生成NaOH再與鹽溶液反應,并判斷是否發生復分解反應
如鈉投入CuSO4溶液中,反應的離子方程式為2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑。
鈉投入BaCl2溶液中,反應的化學方程式為2Na+2H2O===2NaOH+H2↑。
3.鈉與鹽酸的反應
鈉與鹽酸反應的離子方程式為2Na+2H+===2Na++H2↑
三、鈉的制取、保存及用途
1.制取:化學方程式為2NaCl(熔融)通電(=====)2Na+Cl2↑。
2.保存:密封保存,通常保存在石蠟油或煤油中。
3.用途
(1)鈉、鉀合金(液態)可用于原子反應堆的導熱劑。
(2)作強還原劑,將某些稀有金屬從它們的鹵化物中還原出來,如4Na+TiCl4熔融(=====)Ti+4NaCl。
(3)用作電光源,制作高壓鈉燈。
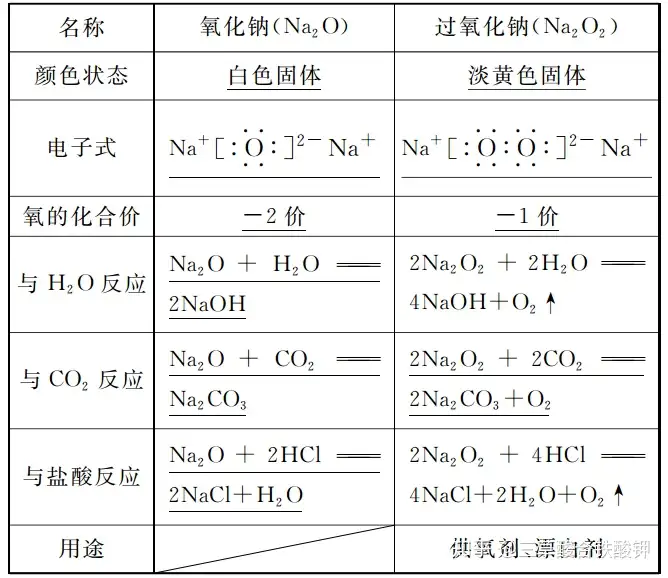
四、氧化鈉與過氧化鈉的比較
總結
1.鈉的取用方法:用鑷子夾取一小塊鈉,用濾紙吸干表面的煤油,用小刀切取黃豆大小的鈉,剩余的鈉放回試劑瓶。
2.鈉失火的處理:沙土蓋滅,不能用水或泡沫滅火器滅火。
3.Na2O2中氧元素的化合價為-1價而不是-2價。
4.Na2O2晶體中陰、陽離子個數比為1∶2而不是1∶1。
5.過氧化鈉與還原性溶液反應的化學方程式的書寫步驟:
第一步:Na2O2與溶液中的水反應生成NaOH和O2;
第二步:反應生成的O2與還原性鹽發生氧化還原反應;
第三步:將上述兩個反應的化學方程式合并,即得總的化學方程式。
6.Na2O2與H2O、CO2反應的兩個常見誤區
(1)Na2O2與H2O、CO2反應都是自身的氧化還原反應;
(2)1 mol Na2O2與足量CO2或H2O發生反應時,轉移的電子數是NA而不是2NA。
1.金屬鈉與鹽或堿溶液反應的思維模板

2.金屬鈉與溶液反應現象分析思維模板
(1)共性:因為鈉與不同的水溶液反應均屬于劇烈的置換反應,故有共同的現象產生:①浮:鈉浮在液面上;②熔:鈉熔化成光亮的小球;③游:在液面上不停地游動直至反應完;④響:反應中不停地發出“嘶嘶”的響聲。
(2)差異性:與酸、強酸弱堿鹽溶液反應時,由于溶液中H+濃度較大,反應比與水還要劇烈,最后鈉可能在液面上燃燒;與鹽溶液反應時,還可能會生成沉淀(如生成難溶堿)、氣體(NH3)等。
1.鈉與氧氣反應的產物與反應溫度有關,加熱或點燃產物是過氧化鈉。
2.不管生成氧化鈉還是過氧化鈉,金屬鈉失電子均變為+1價的陽離子,因而等量的鈉完全反應失去的電子數相同
1.有關Na2O2與CO2、H2O的反應的幾個重要關系
2CO2+2Na2O2===2Na2CO3+O2
2H2O+2Na2O2===4NaOH+O2↑
(1)物質的量的關系
無論是CO2或H2O的單一物質還是二者的混合物,通過足量的Na2O2時,CO2或H2O與放出O2的物質的量之比均為2∶1。
(2)氣體體積關系
若CO2和水蒸氣的混合氣體(或單一氣體)通過足量Na2O2,氣體體積的減少量等于原混合氣體體積的2(1)且等于生成氧氣的體積。
(3)電子轉移關系
當Na2O2與CO2、H2O反應時,物質的量關系為2Na2O2~O2~2e-。
(4)固體質量關系
相當于固體(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作發生相應的反應:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(實際上兩反應不能發生)。
(5)先后順序關系
一定量的Na2O2與一定量的CO2和H2O(g)的混合物的反應,可視作Na2O2先與CO2反應,待CO2反應完成后,Na2O2再與H2O(g)發生反應。
2.增重量等于可燃物質量的規律
凡分子組成符合(CO)m·(H2)n的物質,Wg該物質在O2中完全燃燒,將其產物(CO2和水蒸氣)通過足量的Na2O2后,固體增重必為Wg。或是由C、H、O三種元素組成的物質,只要C、O原子個數比為1∶1,即可滿足該條件。
中學階段常見的符合這一關系的物質有:
(1)無機物:H2、CO及H2和CO的混合氣體。
(2)有機物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等。
過氧化鈉的強氧化性
1.Na2O2與SO2反應:Na2O2+SO2===Na2SO4。
2.Na2O2投入FeCl2溶液中,可將Fe2+氧化成Fe3+,同時生成Fe(OH)3沉淀。
3.Na2O2投入氫硫酸中,可將H2S氧化成單質硫,溶液變渾濁。
4.Na2O2投入Na2SO3溶液中,可將SO3(2-)氧化成SO4(2-)。
5.Na2O2具有漂白性,投入品紅溶液中,可使品紅溶液褪色
鈉的重要化合物
1.碳酸鈉和碳酸氫鈉

2.鈉及其重要化合物間的轉化關系

圖中帶標號的有關反應的化學方程式:
①2Na+O2點燃Na2O2;
②2Na+2H2O===2NaOH+H2↑;
③2Na2O2+2H2O===4NaOH+O2↑;
④2Na2O2+2CO2===2Na2CO3+O2;
⑤2NaOH+CO2===Na2CO3+H2O;
⑥2NaCl+2H2O電解2NaOH+Cl2↑+H2↑。
3.Na2CO3的制備及用途
(1)Na2CO3的工業制備——侯氏制堿法
①制備原理
把二氧化碳通入氨的氯化鈉飽和溶液中,使溶解度較小的碳酸氫鈉從溶液中析出,過濾得到碳酸氫鈉晶體,碳酸氫鈉受熱分解生成碳酸鈉。
②反應的化學方程式
a.NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl;
b.2NaHCO3△(=====)Na2CO3+CO2↑+H2O。
(2)Na2CO3、NaHCO3的用途
①Na2CO3是一種非常重要的化工原料,在玻璃、肥皂、合成洗滌劑、造紙、紡織、石油、冶金、食品等工業中有著廣泛的應用。
②NaHCO3是焙制糕點所用的發酵粉的主要成分之一;在醫療上,它是治療胃酸過多的一種藥劑。
4.Na2CO3和NaHCO3的比較
(1)Na2CO3、NaHCO3的鑒別
①若為固體
可利用加熱法。加熱產生使澄清石灰水變渾濁的氣體的是NaHCO3。
②若為溶液
可利用沉淀法。加入BaCl2溶液,產生白色沉淀的是Na2CO3;也可利用氣體法。滴加稀鹽酸,立即產生氣泡的是NaHCO3,開始無氣泡產生的是Na2CO3。
(2)Na2CO3、NaHCO3和鹽酸的反應
Na2CO3溶液和稀鹽酸反應可理解為分步反應:
Na2CO3+HCl===NaHCO3+NaCl
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3溶液和稀鹽酸反應的化學方程式為
NaHCO3+HCl===NaCl+CO2↑+H2O
①放出CO2的速率
NaHCO3溶液與鹽酸反應放出CO2的速率快。
②Na2CO3溶液與鹽酸的互滴鑒別
向Na2CO3溶液中逐滴加入鹽酸,開始無氣泡產生,而向鹽酸中滴加Na2CO3溶液,開始就有氣泡產生。
③CO2生成量比較
a.等物質的量的Na2CO3、NaHCO3分別與足量的鹽酸反應,產生的CO2相等。
b.等質量的Na2CO3、NaHCO3分別與足量的鹽酸反應,NaHCO3產生的CO2多。
c.等量的鹽酸與足量的Na2CO3、NaHCO3分別反應,NaHCO3產生的CO2多。
d.一定量的NaHCO3受熱分解產生的CO2量與受熱分解后的殘留物與鹽酸反應產生的CO2量相等。
5.數形結合思想理解Na2CO3、NaHCO3與鹽酸的反應
(1)鹽酸逐滴加入Na2CO3溶液中(鹽酸不足時)
①現象:開始無明顯現象,后有無色氣體放出。
②反應:無明顯現象時反應的離子方程式:CO3(2-)+H+===HCO3(-),有無色氣體放出時反應的離子方程式:HCO3(-)+H+===CO2↑+H2O。
(2)Na2CO3溶液逐滴加入稀鹽酸中(鹽酸過量時)
①現象:有無色氣體放出。鑒別Na2CO3、NaHCO3的常用方法
②反應的離子方程式:CO3(2-)+2H+===CO2↑+H2O。
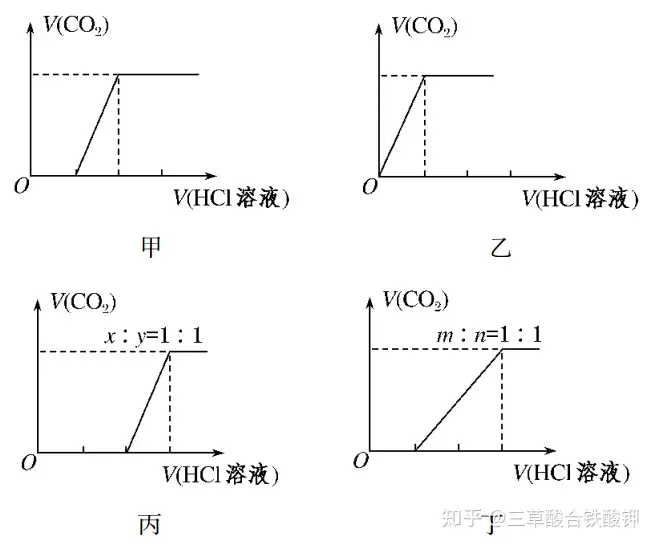
(3)碳酸鈉、碳酸氫鈉與鹽酸反應的基本圖象
①向Na2CO3中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖甲所示。
②向NaHCO3中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖乙所示。
③向NaOH、Na2CO3的混合物中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖丙所示(設NaOH、Na2CO3的物質的量之比為x∶y=1∶1,其他比例時的圖象略)。
④向Na2CO3、NaHCO3的混合物中逐滴加入鹽酸,消耗HCl溶液的體積與產生CO2的體積的關系如圖丁所示(設Na2CO3、NaHCO3的物質的量之比為m∶n=1∶1,其他比例時的圖象略)。
鑒別Na2CO3、NaHCO3的常用方法

歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看