ę╗�Īó╦ßąį╚▄ę║║═ēAąį╚▄ę║
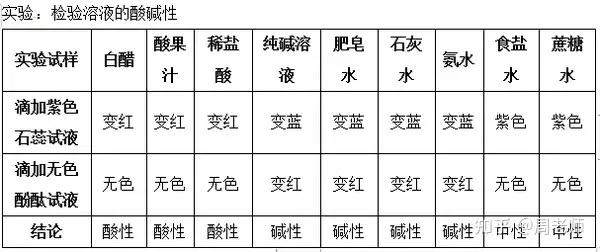
ĮYšōŻ║
(1)Ę▓╩Ū─▄╩╣ūŽ╔½╩»╚’įćę║ūā╝tĄ─╚▄ę║Č╝╩Ū╦ßąį╚▄ę║����Ż¼▓óŪęįō╚▄ę║▓╗─▄╩╣¤o╔½Ęė╠¬įćę║ūā╔½;
(2)Ę▓╩Ū─▄╩╣ūŽ╔½╩»╚’įćę║ūā╦{Ą─╚▄ę║Č╝╩ŪēAąį╚▄ę║��Ż¼▓óŪęįō╚▄ę║─▄╩╣¤o╔½Ęė╠¬įćę║ūā╝t;
(3)▓╗─▄╩╣ūŽ╔½╩»╚’įćę║ūā╔½����Ż¼ę▓▓╗─▄╩╣¤o╔½Ęė╠¬įćę║ūā╔½Ą─╚▄ę║�Ż¼╬ęéāĘQ×ķųąąį╚▄ę║ĪŻ
(4)╚ńūŽ╔½╩»╚’įćę║╝░¤o╔½Ęė╠¬Ą╚─▄Öz“×╚▄ę║╦ßēAąįĄ─įćę║��Ż¼ĘQ×ķ╦ßēAųĖ╩Šä®��ĪŻ
ūóęŌŻ║ó┘╬ęéāėąĢr║“▀Ćė├╦{╔½╗“╝t╔½╩»╚’įć╝łüĒÖz“×╚▄ę║Ą─╦ßēAąį;
ó┌╦ßąį╚▄ę║─▄╩╣╦{╔½╩»╚’įć╝łūā╝t���Ż¼ēAąį╚▄ę║─▄╩╣╝t╔½╩»╚’įć╝łūā╦{;
ó█ų╗ėą┐╔╚▄ąįĄ─╦ßąį�����ĪóēAąį╬’┘|▓┼─▄╩╣ųĖ╩Šä®ūā╔½Ż¼ūā╔½Ą─╩ŪųĖ╩Šä®���Ż¼Č°▓╗╩Ūįō╬’┘|�ĪŻ
2.╚š│Ż╔·╗Ņųą│ŻęŖĄ─╦ßąį╬’┘|┼cēAąį╬’┘|
(1)╦ßąį╬’┘|Ż║╔Įķ½ĪóÖÄ├╩ĪóĖ╠ķ┘����Īó╬„╝t╩┴Ą╚;
(2)ēAąį╬’┘|Ż║▓Ķ╚~ēA�����Īó¤¤ēAĄ╚ĪŻ
3.ģ^Ęų╦ß╚▄ę║║═╦ßąį╚▄ę║ĪóēA╚▄ę║║═ēAąį╚▄ę║
ūóęŌŻ║╦ß╚▄ę║╩ŪųĖ╦ߥ─╦«╚▄ę║Ż¼╦ßąį╚▄ę║╩ŪųĖ─▄╩╣ūŽ╔½╩»╚’įćę║ūā╝tĄ─╚▄ę║�Ż¼ę“┤╦╦ß╚▄ę║ę╗Č©╩Ū╦ßąį╚▄ę║��Ż¼Č°╦ßąį╚▄ę║▓╗ę╗Č©╩Ū╦ß╚▄ę║;═¼śėŻ¼ēAąį╚▄ę║▓╗ę╗Č©╩ŪēA╚▄ę║Ż¼ēA╚▄ę║ę╗Č©╩ŪēAąį╚▄ę║����ĪŻ
└²╚ńŻ║┴“╦ßŃ~���Īó┬╚╗»õ@Ą─╦«╚▄ę║’@╦ßąį�����Ż¼Č°▓╗╩Ū╦ß;╝āēAĪóĘ╩įĒĄ─╦«╚▄ę║’@ēAąį��Ż¼Ą½▓╗╩ŪēA����ĪŻ
4.ča│õų¬ūRŻ║╦ß��ĪóēAĪó¹}Ą─Ė┼─Ņ
(1)╦߯║ļŖļxĢr╔·│╔Ą─Ļ¢ļxūė╚½▓┐╩ŪÜõļxūėĄ─╗»║Ž╬’�ĪŻ╚ńŻ║HCl�ĪóHNO3�ĪóH2SO4ĪóH2CO3Ą╚��ĪŻ
HCl==H++Cl-;H2SO4==2H++SO42-;
(2)ēAŻ║ļŖļxĢr╔·│╔Ą─ĻÄļxūė╚½▓┐╩ŪÜõč§Ė∙ļxūėĄ─╗»║Ž╬’���ĪŻ╚ńŻ║NaOH���ĪóCa(OH)2Ą╚�����ĪŻ
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;
(3)¹}Ż║ļŖļxĢr╔·│╔Įī┘ļxūė(╗“õ@Ė∙ļxūė)║═╦ßĖ∙ļxūėĄ─╗»║Ž╬’ĪŻ╚ńŻ║NaClĪóNH4NO3Ą╚ĪŻ
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;
Č■����Īó╚▄ę║Ą─╦ßēAąįĄ─ÅŖ╚§
1.╦ßēAČ╚Ż║ė├üĒ▒Ē╩Š╚▄ę║Ą─╦ßąį╗“ēAąįĄ─ÅŖ╚§│╠Č╚����ĪŻ
2.pHįć╝łė├üĒČ©┴┐Ą─£yČ©╚▄ę║Ą─╦ßēAČ╚�ĪŻ
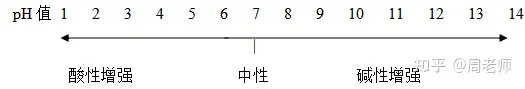
╚▄ę║Ą─pHųĄ┼c╦ßēAąįĻPŽĄ:
pH=7Ż¼╚▄ę║│╩ųąąį;pH<7�Ż¼╚▄ę║│╩╦ßąį���Ż¼ŪępHįĮąĪ���Ż¼╦ßąįįĮÅŖ;pH>7�����Ż¼╚▄ę║│╩ēAąįŻ¼Ūę
pHįĮ┤¾Ż¼ēAąįįĮÅŖĪŻ
3.pHįć╝łĄ─╩╣ė├ĘĮĘ©:
ė├─zŅ^Ą╬╣▄(╗“▓Ż┴¦░¶)░č┤²£yįćę║Ą╬(╗“═┐)į┌pHįć╝ł╔ŽŻ¼╚╗║¾░čįć╝ł’@╩ŠĄ─Ņü╔½(░ļĘųńŖā╚)┼cś╦£╩▒╚╔½┐©ī”šš���Ż¼ś╦£╩▒╚╔½┐©╔ŽŽÓ═¼Ņü╔½Ą─pH╝┤×ķįō╚▄ę║Ą─pHĪŻ
ūóęŌŻ║
(1)▓╗─▄ų▒Įė░čpHįć╝łĮ■╚ļ┤²£y╚▄ę║ųąŻ¼ęį├ŌĦ╚ļļs┘|�Ż¼═¼Ģr▀@ĘN▓┘ū„┐╔─▄┼▌Ą¶pHįć╝ł╔Ž
ę╗▓┐ĘųųĖ╩Šä®����Ż¼ęįų┬▒╚╔½░l╔·▌^┤¾Ą─š`▓Ņ;
(2)▓╗─▄Ž╚ė├╦«īópHįć╝łØÖر�����Ż¼į┘▀Mąą£yįćŻ¼ę“×ķ╦«ØÖر║¾Ą─pHįć╝łīó£yČ©Ą─╩ŪŽĪßī║¾╚▄
ę║Ą─pH��ĪŻ
(3)╬ęéāīŹ“×╩ęę╗śė╩╣ė├Ą─pHįć╝ł╩ŪÅVĘ║pHįć╝ł����Ż¼£y│÷Ą─pHųĄ╩Ū1~14Ą─š¹öĄĪŻ
(4)×ķ┴╦▒╚▌^Š½┤_Ą─£yČ©╚▄ę║Ą─pH�����Ż¼╬ęéā┐╔ęįė├Š½├▄pHįć╝ł║═╦ßČ╚ėŗ(ėųĘQpHėŗ)üĒ£y┴┐�ĪŻ
╚²Īó╚▄ę║╦ßēAąį┼c╔·├³╗ŅäėĄ─ĻPŽĄ
1.╚╦Ą─¾wę║ėąę╗Č©Ą─╦ßēAČ╚�ĪŻč¬ę║����ĪóĮM┐Śķgę║║═╝Ü░¹ā╚ę║Ą─╦ßēAČ╚Č╝ĮėĮ³ė┌ųąąį�����Ż¼Č°Ūęūā╗»śOąĪ;
2.╬Ėę║Ą─pHį┌0.9~1.5ų«ķg��Ż¼į┌▀@śėĄ─ŁhŠ│ųąĶFą╝Č╝┐╔▒╗╚▄ĮŌŻ¼Ą½╬Ė▒Š╔Ēģs─▄░▓╚╗¤oĒ”����ĪŻę“×ķ╬Ė└’ėąę╗īė“š│ę║Ų┴šŽ”�����Ż¼╦³╩Ūė╔š│ę║╝Ü░¹║═╔ŽŲż╝Ü░¹Ęų├┌│÷Ą─ę╗ĘN─zā÷ĀŅš│ę║Ż¼į┌╬Ėš│─ż▒Ē├µśŗ│╔ę╗éĆ▒Żūo─ż��Ż¼ė├üĒ▒Żūo╬Ė�����Ż¼Ę└ų╣╬Ė╦ßī”Ųõ▒Š╔ĒĄ─Ė»╬g╝░╬ĖĄ░░ū├Ėī”╬Ė▒Š╔ĒĄ─Ž¹╗»���Ż¼▀Ć─▄Ę└ų╣┤ų▓┌Ą─╩│╬’ī”╬ĖĄ─ÖCąĄąįōpé¹�����ĪŻ
3.┤¾ČÓöĄĄ─▐rū„╬’▀mę╦į┌ĮėĮ³ųąąį(pHį┌6.5~7.5ų«ķg)Ą─═┴╚└ųą╔·ķLŻ¼į┌Ė─┴╝╦ßąį═┴╚└Ģr��Ż¼╬ęéāę╗░Ń╩Ū╩╣ė├╩ņ╩»╗ęüĒš{╣ØŲõ╦ßēAČ╚�����ĪŻ
4.ėĻ╦«ę╗░Ń│╩┬į╦ßąį(ė╔ė┌┐šÜŌųąĄ─Č■č§╗»╠╝╚▄ĮŌį┌ėĻ╦«ųą)�Ż¼╚╦éāę╗░Ń░čpHąĪė┌5.6 Ą─ėĻ╦«ĘQ×ķ╦ßėĻ����ĪŻ
§7.2 │ŻęŖĄ─╦ß║═ēA
ę╗Īó│ŻęŖĄ─╦ß
1.╔·╗Ņųą│Żė├Ą─╦߯║╬Ėę║ųą║¼ėąĄ─¹}╦ß(HCl)�����Ż¼ąŅļŖ│žųą║¼ėą┴“╦ß(H2SO4)���Ż¼╦ßėĻųą║¼ėąĄ─┴“╦ß╝░Ž§╦ß(HNO3)���Ż¼╩│┤ūųą║¼ėąĄ─┤ū╦ß(CH3COOH╗“HAc);’ŗ┴Žųą┐╔─▄║¼ėąĄ─╠╝╦ß���ĪóÖÄ├╩╦ߥ╚���ĪŻ
2.╦ߥ─ĘųŅÉŻ║¤oč§╦ß(╚ńHCl)�Īó║¼č§╦ß(HNO3���ĪóH2SO4)Ą╚�����ĪŻ
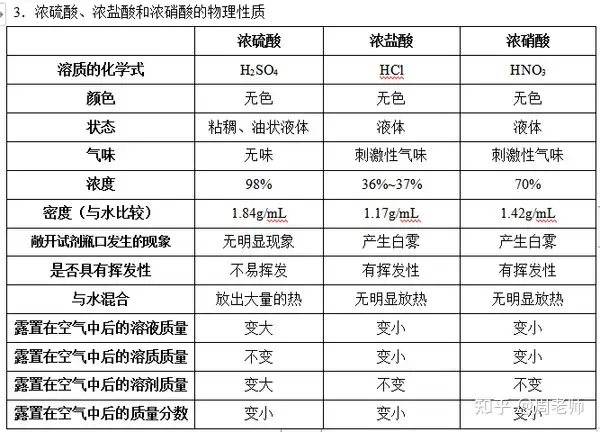
ūóęŌŻ║ØŌ┴“╦ߊ▀ėąę╗Č©Ą─╠žąįŻ║
(1)╬³╦«ąį(╬’└Ēąį┘|)ė├ė┌ÜŌ¾wĖ╔į’�����Ż¼Ą½│²NH3Ą╚ēAąįÜŌ¾w│²═Ō[2NH3+ H2SO4== (NH4)2SO4]
(2)├ō╦«ąį(╗»īWąį┘|)——║┌├µ░³īŹ“×(ØŌ┴“╦ß┼cšß╠ŪĘ┤æ¬Ż¼╩╣ų«╠┐╗»ĪŻ)
(3)ÅŖč§╗»ąį����Ż¼Ė»╬gąį——┼cĮī┘░l╔·Ę┤æ¬��Ż¼╔·│╔Ą─ÜŌ¾w▓╗╔·│╔ÜõÜŌČ°╩ŪČ■č§╗»┴“ĪŻ
į┌╝ė¤ßĄ─Śl╝■Ž┬Ż¼─▄┼c┼┼į┌Üõ║¾├µĄ─Įī┘(╚ńCu)Ę┤æ¬Ż¼╚ńŻ║
Cu+2H2SO4(ØŌ)Ī„==CuSO4+SO2↑+H2O
ėų╚ń���Ż¼└õĄ─ØŌ┴“╦ß┼cĶF╗“õXĘ┤æ¬║¾Ż¼─▄╔·│╔ę╗īėų┬├▄Ą─č§╗»─żŻ¼ūĶų╣Ę┤æ¬▀Mę╗▓Į▀Mąą��ĪŻ
(4)ØŌ┴“╦ߥ─ŽĪßīŻ║╦ß╚ļ╦«��Ż¼čžŲ„▒┌��Ż¼▓╗öÓöć░ĶĪŻ
ØŌ┴“╦ß╚▄ė┌╦«Ę┼│÷┤¾┴┐Ą─╦«Ż¼ūŃęį╩╣╦«ĘųĘą“v��Ż¼▓óŪę╦«Ą─├▄Č╚ąĪė┌ØŌ┴“╦ߥ─├▄Č╚�ĪŻ╚ń╣¹░č╦«Ą╣╚ļØŌ┴“╦ßųąŻ¼╦«Š═Ģ■ĖĪį┌ØŌ┴“╦ß╔Ž├µŻ¼╚▄ĮŌĢrĘ┼│÷┤¾┴┐Ą─¤ßŻ¼ų┬╩╣╦«Ęą“vČ°╩╣┴“╦ßę║Ą╬Ž“╦─ų▄’w×RČ°įņ│╔╩┬╣╩ĪŻ
(5)░▓╚½╩┬╣╩Ą─╠Ä└ĒŻ║ØŌ┴“╦ß×RĄĮŲż─w╔Ž║¾��Ż¼╩ūŽ╚čĖ╦┘ė├─©▓╝īóŲõ▓┴╩├�Ż¼╚╗║¾ė├┤¾┴┐╦«ø_Ž┤����Ż¼ūŅ║¾ė├3%~5%Ą─NaHCO3═┐Ę¾ĪŻ
ŽĪ┴“╦ß×RĄĮŲż─w╔Ž║¾�Ż¼æ¬įō±R╔Žø_Ž┤����Ż¼ę“×ķļSų°ŽĪ┴“╦ßųą╚▄䮥─š¶░lŻ¼ę▓Ģ■ūā│╔ØŌ┴“╦ßĪŻ
4.╦ߥ─╗»īWąį┘|
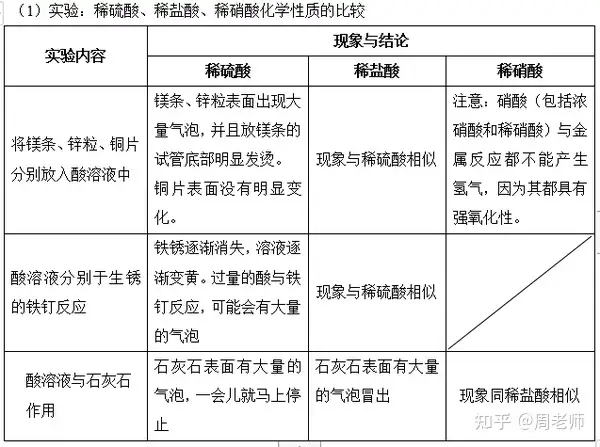
┐éĮYŻ║╦ß╦∙Š▀ėąĄ─╣▓═¼╠ž³cŻ║
╦ßį┌╦«╚▄ę║ųąČ╝─▄ļŖļx│÷ÜõļxūėŻ¼ę“┤╦╦ß╚▄ę║Ģ■Š▀ėąįSČÓ╣▓═¼Ą─ąį┘|(╦ߥ─╬Õ┤¾═©ąį)Ż║
(1)╦ß╚▄ę║┼c╦ßēAųĖ╩Šä®Ą─Ę┤æ¬
A.ūŽ╔½╩»╚’įćę║╗“╦{╔½╩»╚’įć╝łė÷ĄĮ╦ß╚▄ę║ūā╝t╔½;
B.¤o╔½Ęė╠¬įćä®ė÷ĄĮ╦ß╚▄ę║▓╗ūā╔½��ĪŻ
╠ßąčŻ║ūŽ╔½╩»╚’įćä®ūā╔½Ūķør×ķŻ║“╦ß╝tēA╦{”;╩ŪųĖ╩Šä®ūā╔½�Ż¼Č°ĘŪ┤²£y╚▄ę║▒Š╔Ēūā╔½ĪŻ
(2)╦ß╚▄ę║┼c─│ą®Įī┘Ę┤æ¬
╦ß╚▄ę║+ (ÜõŪ░)Įī┘→ ¹}╚▄ę║+ ÜõÜŌ
ūóęŌŻ║
A.į┌Įī┘╗ŅäėąįĒśą“▒ĒųąŻ¼┼┼į┌ÜõŪ░├µĄ─Įī┘─▄ų├ōQ│÷╦ßųąĄ─Üõ���Ż¼┼┼į┌Üõ║¾├µĄ─Įī┘ät▓╗─▄;
B.┼┼į┌Įī┘╗ŅäėąįĒśą“▒ĒįĮŪ░├µĄ─Įī┘Ż¼Ę┤欼FŽ¾įĮäĪ┴ęŻ¼╦┘Č╚įĮ┐ņ����Ż¼╚ńMgĘ┤æ¬ėą├„’@Ę┼
¤ß¼FŽ¾;
C.ÅŖč§╗»ąį╦ß┼cĮī┘Ę┤æ¬║¾�����Ż¼▓╗─▄╔·│╔ÜõÜŌŻ¼Č°╩Ū╔·│╔╦«ĪŻ╚ńØŌ┴“╦ßĪóŽ§╦ߥ╚ÅŖč§╗»ąį╦ß;
D.įōŅÉĘ┤æ¬ī┘ė┌ų├ōQĘ┤æ¬
╚ńŻ║Zn + 2HCl == ZnCl2+ H2↑;Fe + H2SO4== FeSO4 + H2↑
(3)╦ß╚▄ę║┼c─│ą®Įī┘č§╗»╬’Ę┤æ¬(Įī┘č§╗»╬’ėųĘQēAąįč§╗»╬’)
╦ß╚▄ę║+ Įī┘č§╗»╬’→ ¹}╚▄ę║+ ╦«
ūóęŌŻ║įōĘ┤æ¬▀^│╠ųąŻ¼Įī┘į¬╦žĄ─╗»║Žār▓╗ūā���Ż¼╦ßųąĄ─įŁūėłF▓╗ūā
╚ńŻ║CuO + 2HCl == CuCl2+ H2O;Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
ZnO + 2HNO3== Zn(NO3)2+H2O
(4)╦ß╚▄ę║┼cēAĄ─Ę┤æ¬(ėųĘQ×ķųą║═Ę┤æ¬)
╦ß+ēA→¹}+╦«
(5)╦ß╚▄ę║┼c─│ą®¹}Ę┤æ¬
╦ß╚▄ę║+ ¹}→ ą┬╦ß+ ą┬¹}
ūóęŌŻ║A.╬ęéā═©│Żė÷ĄĮĄ─¹}╩Ū╠╝╦ß¹}Ż¼ę“┤╦Į^┤¾▓┐ĘųĘ┤æ¬╩ŪŻ║
╦ß+ ╠╝╦ß¹}→ ą┬¹}+ ╦«+ Č■č§╗»╠╝
╚ńŻ║CaCO3+ 2HCl == CaCl2+ H2O + CO2↑;Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑;
K2CO3+ 2HNO3== 2KNO3+ H2O + CO2↑;
MgCO3+ CH3COOH == (CH3COO)2Mg + H2O + CO2↑;
B.─│ą®╠ž╩ŌĄ─¹}─▄┼c╦ßĘ┤æ¬Ż¼╔·│╔╠ž╩ŌĄ─│┴ĄĒ
╚ńŻ║HCl + AgNO3== AgCl↓+ HNO3;BaCl2+ H2SO4== BaSO4↓+ 2HCl
ča│õŻ║Cl-╝░SO42-Ą─Öz“×
A.Ž“┤²£y╚▄ę║ųą╝ė╚ļAgNO3╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔�Ż¼Ą╬╚ļŽĪŽ§╦ß╚▄ę║║¾����Ż¼│┴ĄĒ▓╗Ž¹╩¦����Ż¼ät╚▄ę║ųą║¼ėąCl-Ż¼╚ń╣¹ø]ėą│┴ĄĒ╗“š▀│┴ĄĒŽ¹╩¦�����Ż¼ät▓╗║¼ėąCl-����ĪŻ
B.Ž“┤²£y╚▄ę║ųą╝ė╚ļBa(NO3)2╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔�����Ż¼Ą╬╚ļŽĪŽ§╦ß╚▄ę║║¾��Ż¼│┴ĄĒ▓╗Ž¹╩¦Ż¼ät╚▄ę║ųą║¼ėąSO42-���Ż¼╚ń╣¹ø]ėą│┴ĄĒ╗“š▀│┴ĄĒŽ¹╩¦Ż¼ät▓╗║¼ėąSO42-����ĪŻ
Č■.│ŻęŖĄ─ēA
1.ėąĻPēAĄ─ę╗ą®ąį┘|▒╚▌^
¤²ēAŠ▀ėąÅŖĖ»╬gąį�����Ż¼Üõč§╗»Ō}║═░▒╦«ę▓Š▀ėąę╗Č©Ą─Ė»╬gąįĪŻ
Üõč§╗»Ōc╚▄ę║─▄ē“┼cŅ^░l�����ĪóļuĄ░ŪÕ�����Īóų▓╬’ė═Ą╚░l╔·╗»īWĘ┤æ¬���Ż¼╚▄ĮŌŲõųąĄ─Ą░░ū┘|ĪŻ
2.ēAĄ─╣▓═¼ąį┘|
ė╔ė┌ēAļŖļx║¾Č╝─▄╔·│╔OH-Ż¼ę“┤╦ę▓Š▀ėąŽÓ═¼Ą─ąį┘|(ēAĄ─╦─┤¾═©ąį)Ż║
╚ńŻ║NaOH == Na++ OH-;NH3•H2O == NH4++OH-;
(1)┼c╦ßēAųĖ╩Šä®ū„ė├
A.ūŽ╔½╩»╚’įćä®╗“╝t╔½╩»╚’įć╝łė÷ĄĮēA╚▄ę║ūā╦{;
B.¤o╔½Ęė╠¬ė÷ĄĮēA╚▄ę║ūā╝t��ĪŻ
(2)┼c─│ą®ĘŪĮī┘č§╗»╬’Ę┤æ¬(ĘŪĮī┘č§╗»╬’ėųĘQ╦ßąįč§╗»╬’)
ēA╚▄ę║+ ĘŪĮī┘č§╗»╬’→ ¹}+ ╦«
╚ńŻ║2NaOH + CO2== Na2CO3+ H2O;Ca(OH)2+ SO2== CaSO3↓+ H2O;
(3)┼c╦ß╚▄ę║Ą─Ę┤æ¬
ēA+╦ß→¹}+╦«
(4)─▄┼c─│ą®¹}Ę┤æ¬
ēA╚▄ę║+ ¹}╚▄ę║→ ą┬¹}+ ą┬ēA
╚ńŻ║CuSO4+ 2NaOH == Na2SO4+ Cu(OH)2↓Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
3.Å═ĘųĮŌĘ┤æ¬Ż║ėąā╔ĘN╗»║Ž╬’ŽÓ╗źĮ╗ōQ│╔Ęų�����Ż¼╔·│╔┴Ē═Ōā╔ĘN╗»║Ž╬’Ą─Ę┤æ¬�����ĪŻ
┐╔ęįė├Ż║AB + CD == AD + CB ▒Ē╩ŠĪŻ
╠ž³cŻ║(1)Ę┤æ¬╬’Īó╔·│╔╬’Š∙ų╗ėąā╔ĘN╗»║Ž╬’;
(2)░l╔·Ę┤æ¬Ą─ā╔ĘN╗»║Ž╬’ŽÓ╗źĮ╗ōQ│╔Ęų;
(3)Ė„į¬╦žĄ─╗»║Žārį┌Ę┤æ¬Ū░║¾Š∙▓╗Ė─ūā����ĪŻ
ūóŻ║ļy╚▄ąįēA╩▄¤ßęūĘųĮŌ(▓╗ī┘ė┌ēAĄ─═©ąį)
§7.3 ÄūĘNųžę¬Ą─¹}
ę╗���Īó¹}
1.¹}Ą─ĘųŅÉŻ║ę└ō■ĮM│╔¹}Ą─Ļ¢ļxūė║═╦ßĖ∙Ą─ĘNŅÉ▀MąąĘųŅÉ
Ė∙ō■Ļ¢ļxūėĄ─▓╗═¼�Ż¼¹}┐╔ęįĘų×ķŌc¹}ĪóŌø¹}����ĪóµV¹}����ĪóĶF¹}����Īóõ@¹}Ą╚ĪŻ(┬╚╗»Ōc×ķŌc¹})
Ė∙ō■╦ßĖ∙Ą─▓╗═¼����Ż¼¹}┐╔ęįĘų×ķ┴“╦ß¹}����Īó╠╝╦ß¹}����ĪóŽ§╦ß¹}��Īó¹}╦ß¹}Ą╚���ĪŻ(┬╚╗»Ōc×ķ¹}╦ß¹})
2.╦ß��ĪóēAĪó¹}Ą─╚▄ĮŌąįęÄ┬╔Ż║
ó┘╦ßČ╝╚▄;ó┌╚▄ēAėą╬Õ╬╗Ż║ŌøĪóŌc�����Īóõ@���ĪóŌ}�����Īóõ^;ó█Ōø¹}�����ĪóŌc¹}Īóõ@¹}�ĪóŽ§╦ß¹}Č╝┐╔╚▄;ó▄¹}╦ß¹}ų╗ėą┬╚╗»Ńy▓╗┐╔╚▄;ó▌┴“╦ß¹}ų╗ėą┴“╦ßõ^▓╗┐╔╚▄;ó▐╠╝╦ß¹}ų╗╚▄Ōø���ĪóŌc�����Īóõ@Ż¼╩ŻŽ┬Č╝▓╗╚▄ĪŻ
ūóęŌŻ║AgCl��ĪóBaSO4▓╗āH▓╗╚▄ė┌╦«����Ż¼Č°Ūę▓╗╚▄ė┌ŽĪŽ§╦ß����ĪŻ
Ų▀ĘN│ŻęŖ│┴ĄĒŻ║AgCl↓BaSO4↓Cu(OH)2↓F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓
3.¹}Ą─╗»īWąį┘|Ż║
(1)¹} + Įī┘ → ą┬¹} + ą┬Įī┘
į┌Įī┘╗ŅäėąįĒśą“▒ĒųąŻ¼│²ĘŪ│��Ż╗ŅØŖĄ─Įī┘═Ō�Ż¼┼┼į┌Ū░├µĄ─Įī┘ę╗░Ń┐╔ęįīó╬╗ė┌Ųõ║¾├µĄ─Īó▒╚╦³▓╗╗ŅØŖĄ─Įī┘Å─╦³éāĄ─¹}╚▄ę║ųąų├ōQ│÷üĒ��Ż¼╚ńŻ║
Zn + CuSO4== ZnSO4 + Cu Cu + 2AgNO3== 2Ag + Cu(NO3)2
(2)─│ą®¹}╚▄ę║į┌ę╗Č©Śl╝■Ž┬─▄┼c╦ß╗“ēA░l╔·Å═ĘųĮŌĘ┤æ¬
Å═ĘųĮŌĘ┤æ¬Ż║ė╔ā╔ĘN╗»║Ž╬’╗źŽÓĮ╗ōQ│╔Ęų�Ż¼╔·│╔┴Ē═Ōā╔ĘN╗»║Ž╬’Ą─Ę┤æ¬ĪŻ
╚ńŻ║CuSO4+ Ca(OH)2 === Cu(OH)2↓ + CaSO4
Na2CO3+2HCl == 2NaCl+H2O+CO2↑
Å═ĘųĮŌĘ┤æ¬░l╔·Ą─Śl╝■Ż║
a.ėą│┴ĄĒ╔·│╔;b.ėąÜŌ¾wĘ┼│÷;c.ėą╦«╔·│╔;
d.╚ń╣¹╩Ūø]ėą╦ßģó╝ėĄ─Ę┤æ¬����Ż¼ätā╔ĘNĘ┤æ¬╬’▒žĒÜČ╝╚▄ė┌╦«�����ĪŻ
Č■����ĪóÄūĘN│ŻęŖĄ─¹}
1.┬╚╗»Ōc(NaCl)
į┌ūį╚╗ĮńųąĘų▓╝║▄ÅVĘ║���Ż¼║Ż╦«ųą║¼ėą┤¾┴┐┬╚╗»Ōc��ĪŻ
2.╠╝╦ßŌc(Na2CO3)
(1)╦ū├¹Ż║╝āēA��Īó╠K┤“(2)╝āēA▓╗╩ŪēAŻ¼╩Ū¹}(╦«╚▄ę║’@ēAąį)
(3)ė├═ŠŻ║▓Ż┴¦Īóįņ╝ł���Īó╝Å┐Ś║═Ž┤£ņ䮥─╔·«aĄ╚
(4)Na2CO3+ 2HCl === 2NaCl + CO2↑+ H2O
3.╠╝╦ßÜõŌc(NaHCO3)
(1)╦ū├¹Ż║ąĪ╠K┤“(2)ė├═ŠŻ║▒║ųŲĖŌ³cĪóų╬»¤╬Ė╦ß▀^ČÓ
(3)NaHCO3+ HCl === NaCl + CO2↑+ H2O
4.╠╝╦ßŌ}(CaCO3)
(1)┤¾└Ē╩»Īó╩»╗ę╩»�ĪóńŖ╚ķ╩»ĪóžÉÜż����Īóšõųķ��ĪóĄ░ÜżĪóÕüĀt║═╦«ēžĄ─╦«╣ĖĄ─ų„ę¬│╔Ęų
(2)ė├═ŠŻ║Į©ų■▓─┴Ž���ĪóčaŌ}ä®(3)CaCO3+2HCl===CaCl2+ CO2↑+H2O
ča│õŻ║╠╝╦ß¹}(CO32-ĪóHCO3-)Ą─Öz“ׯ║
A.Ž“┤²£y╚▄ę║ųą╝ė╚ļŽĪHCl║¾ėąÜŌ┼▌╔·│╔�����Ż¼īó«a╔·Ą─ÜŌ¾w═©╚ļ│╬ŪÕ╩»╗ę╦«����Ż¼╚¶│╬ŪÕ╩»╗ę
╦«ūā£åØ߯¼ät╚▄ę║ųą║¼ėąCO32-;╚¶│╬ŪÕ╩»╗ę╦«¤oūā╗»��Ż¼ät╚▄ę║ųą▓╗║¼ėąCO32-����ĪŻ
B.Ž“┤²£y╚▄ę║ųą╝ė╚ļBaCl2╚▄ę║║¾ėą░ū╔½│┴ĄĒ╔·│╔Ż¼Ą╬╚ļŽĪHCl║¾���Ż¼│┴ĄĒŽ¹╩¦ŪęėąÜŌ┼▌╔·
│╔Ż¼ät╚▄ę║ųą║¼ėąCO32-�ĪŻ
CaCO3+ 2HCl == CaCl2+ H2O + CO2↑
Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
NaHCO3+ HCl == NaCl + H2O + CO2↑
╚²�Īó╗»īWĘ╩┴Ž
▐rū„╬’Ą─╔·ķLąĶę¬N�ĪóPĪóKĄ╚ĀIBį¬╦ž��ĪŻ║¼ėą▀@ą®į¬╦žĄ──│ą®╬’┘|┐╔ęįū„×ķĘ╩┴Ž�����ĪŻ═©▀^╗»īW╝ė╣ż╔·«aĄ─Ę╩┴Ž�����Ż¼ĘQū„╗»īWĘ╩┴Ž���ĪŻ
1�Īó│Żė├Ą─Ę╩┴ŽŻ║
╗»īWĘ╩┴ŽŻ║░▒ÜŌ(NH3·H2O)Īó╠╝╦ßÜõõ@(NH4HCO3)Īó┴“╦ßŌø(K2SO4)Īó┴ūĄVĘ█[ų„ę¬│╔Ęų┴ū╦ßŌ}Ca3(PO4)2]��Īó┴“╦ßõ@[(NH4)2SO4]�Īó─“╦ž[CO(NH2)2]ĪóŽ§╦ßŌø(KNO3)Īó┴ū╦ßČ■Üõõ@(NH4H2PO4)�ĪŻ
▐r╝ęĘ╩┴ŽŻ║╚ńIJĘ╩��Īó╚╦╝S─“ĪóŠGĘ╩Ą╚ĪŻ
2ĪóĄ¬Ę╩ū„ė├Ż║┤┘▀Mų▓╬’Ūo��Īó╚~╔·ķL├»╩ó�����Īó╚~╔½ØŌŠG(┤┘├ń)╚▒Ą¬Ż║╚~³S
ŌøĘ╩ū„ė├Ż║┤┘╩╣ū„╬’╔·ķLĮĪēč�ĪóŪoŚU┤ųė▓�Ż¼┐╣Ą╣Ę³(ēčČÆ)╚▒ŌøŻ║╚~╝Ō░l³SŻ¼ęūĄ╣Ę³
┴ūĘ╩ū„ė├Ż║┤┘▀Mų▓╬’Ė∙ŽĄ░l▀_�����Ż¼╦ļ┴Żį÷ČÓ���Ż¼’¢ØM(┤▀╣¹)╚▒┴ūŻ║╔·ķL▀tŠÅŻ¼«a┴┐ĮĄ
Ą═�����Ż¼Ė∙ŽĄ▓╗░l▀_
4���Īóõ@æBĄ¬Ę╩┼cēA╗ņ║Ž╝ė¤ß�Ż¼Č╝ėą░▒ÜŌĘ┼│÷:
(NH4)2SO4+ 2NaOH Ī„==Na2SO4 + 2NH3↑+ 2H2O
NH4NO3+NaOH Ī„==NaNO3+NH3↑+H2O
░▒ÜŌėą┤╠╝żąįÜŌ╬Č���Ż¼─▄╩╣رØÖĄ─╝t╔½╩»╚’įć╝łūā╦{��Ż¼▀@ą®┐╔ė├ė┌õ@æBĄ¬Ę╩Ą─Öz“×�����ĪŻ
NH4+Ą─Öz“×:
įć䮯║ēA(NaOHĪóCa(OH)2Ą╚)ĪóرØÖĄ─╝t╔½╩»╚’įć╝ł
ĖĮŻ║å╬┘|�����Īóč§╗»╬’�����Īó╦ß��ĪóēAĪó¹}Ą─ŽÓ╗źĻPŽĄ
(1)Įī┘å╬┘|+╦ß---¹}+ÜõÜŌ(ų├ōQĘ┤æ¬)
1.õ\║═ŽĪ┴“╦ßZn+H2SO4=ZnSO4+H2↑(ūŅ│Żė├)
(īŹ“×╩ęųŲH2ė├Ą─Įī┘ėąZn,Fe,Mg,AlŻ¼╦ßėąŽĪH2SO4║═ŽĪHCl)
(2)Įī┘å╬┘|+¹}(╚▄ę║)---┴Ēę╗ĘNĮī┘+┴Ēę╗ĘN¹}
2.ĶF║═┴“╦ßŃ~╚▄ę║Ę┤æ¬Ż║Fe+CuSO4=FeSO4+Cu
3.õX║═Ž§╦ßŃy╚▄ę║Ę┤æ¬Ż║Al+3AgNO3=Al(NO3)3+3Ag
(3)ēAąįč§╗»╬’(Įī┘č§╗»╬’)+╦ß---¹}+╦«
4.č§╗»ĶF║═ŽĪ┴“╦ßĘ┤æ¬Ż║Fe2O3+3H2SO4=Fe2(SO4)3+3H2 O
5.č§╗»Ō}║═ŽĪ¹}╦ßĘ┤æ¬Ż║CaO+2HCl=CaCl2+H2 O
(4)╦ßąįč§╗»╬’(ĘŪĮī┘č§╗»╬’)+ēA--------¹}+╦«
6.┐┴ąįŌc▒®┬Čį┌┐šÜŌųąūā┘|Ż║2NaOH+CO2=Na2CO3+H2 O
7.Ž¹╩»╗ęĘ┼į┌┐šÜŌųąūā┘|Ż║Ca(OH)2+CO2=CaCO3↓+H2 O
(5)╦ß+ēA--------¹}+╦«(ųą║═Ę┤æ¬)
8.¹}╦ß║═¤²ēAĘ┤æ¬Ż║HCl+NaOH=NaCl+H2O
9.¹}╦ß║═Üõč§╗»Ō}Ę┤æ¬Ż║2HCl+Ca(OH)2=CaCl2+2H2 O
10.Üõč§Ōc║═┴“╦ßĘ┤æ¬Ż║2NaOH + H2SO4==Na2SO4+2H2O
(6)╦ß+¹}--------┴Ēę╗ĘN╦ß+┴Ēę╗ĘN¹}
11.┤¾└Ē╩»┼cŽĪ¹}╦ßĘ┤æ¬Ż║CaCO3+2HCl=CaCl2+H2 O+CO2↑(īŹ“×╩ęųŲCO2)
12.╠╝╦ßŌc┼cŽĪ¹}╦ßĘ┤æ¬:Na2CO3 +2HCl=2NaCl+H2 O+CO2↑
13.┴“╦ß║═┬╚╗»õ^╚▄ę║Ę┤æ¬Ż║H2SO4+BaCl2=BaSO4↓+2HCl
(7)ēA+¹}---┴Ēę╗ĘNēA+┴Ēę╗ĘN¹}
14.Üõč§╗»Ō}┼c╠╝╦ßŌcŻ║Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
15.┴“╦ßŃ~╚▄ę║┼cÜõč§╗»õ^Ż║CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
(8)¹}+¹}---ā╔ĘNą┬¹}
16.┬╚╗»Ōc╚▄ę║║═Ž§╦ßŃy╚▄ę║Ż║NaCl+AgNO3=AgCl↓+NaNO3
17.┴“╦ßŌc║═┬╚╗»õ^Ż║Na2SO4+BaCl2=BaSO4↓+2NaCl
Å═ĘųĮŌĘ┤æ¬▒žĒÜ╔·│╔│┴ĄĒ��Ż¼ÜŌ¾w╗“╦«╔·│╔▓┼─▄░l╔·�Ż¼Ūę╔·│╔╬’Ą─į¬╦ž╗»║Žār▓╗ūāĪŻ
+1ār:HClO;NaClO;Ca(ClO)2.
+5ār:HClO3;KClO3.
+7ār:HClO4;KClO4.
ĪĪĪĪ ÜgėŁ╩╣ė├╩ųÖCĪóŲĮ░ÕĄ╚ęŲäėįOéõįLå¢ųą┐╝ŠW�Ż¼2023ųą┐╝ę╗┬Ę┼Ń░ķ═¼ąą�����ŻĪ>>³cō¶▓ķ┐┤
















