來源:網絡資源 2022-12-07 20:26:54
一、物態變化的含義
1.物態變化
物質由一種狀態變為另一種狀態的過程
2.性質
首先利用分子動理論從微觀意義上解釋物態變化的本質
2.1物質是由大量的分子組成的
2.2分子永不停息地做著無規則的運動
2.3分子之間是有間隔的,并且存在相互作用力:引力和斥力
二、凝固知識點
1.凝固定義:
物質從液態變成固態的過程,需要放熱。
2.凝固現象:
①“滴水成冰”②“銅水”澆入模子鑄成銅件
3.凝固規律:
①晶體在凝固過程中,要不斷地放熱,但溫度保持在熔點不變。
②非晶體在凝固過程中,要不斷地放熱,且溫度不斷降低。
4.晶體凝固必要條件:
溫度達到凝固點、不斷放熱。
5.凝固放熱:
①北方冬天的菜窖里,通常要放幾桶水。(利用水凝固時放熱,防止菜凍壞)
②煉鋼廠,“鋼水”冷卻變成鋼,車間人員很易中暑。(鋼水凝固放出大量的熱)
6.同一晶體的熔點和凝固點相同;
7.注意:
7.1物質熔化和凝固所用時間不一定相同,這與具體條件有關;
7.2熱量只能從溫度高的物體傳給溫度低的物體,發生熱傳遞的條件是:物體之間存在溫度差;
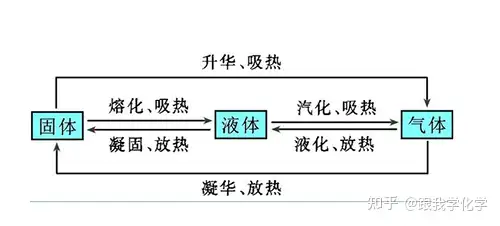
三、熔化知識點
1.熔化定義:
物質從固態變成液態的過程需要吸熱。
2.熔化現象:
①春天“冰雪消融”
②煉鋼爐中將鐵化成“鐵水”
3.熔化規律:
①晶體在熔化過程中,要不斷地吸熱,但溫度保持在熔點不變。
②非晶體在熔化過程中,要不斷地吸熱,且溫度不斷升高。
4.晶體熔化必要條件:
溫度達到熔點、不斷吸熱。
5.有關晶體熔點(凝固點)知識:
①萘的熔點為80.5℃。
當溫度為790℃時,萘為固態。
當溫度為81℃時,萘為液態。
當溫度為80.50℃時,萘是固態、液態或固、液共存狀態都有可能。
②下過雪后,為了加快雪熔化,常用灑水車在路上灑鹽水。(降低雪的熔點)
③在北方,冬天溫度常低于-39℃,因此測氣溫采用酒精溫度計而不用水銀溫度計。
6.熔化吸熱的事例:
①夏天,在飯菜的上面放冰塊可防止飯菜變餿。(冰熔化吸熱,冷空氣下沉)
②化雪的天氣有時比下雪時還冷。(雪熔化吸熱)
③鮮魚保鮮,用0℃的冰比0℃的水效果好。(冰熔化吸熱)
④“溫室效應”使極地冰川吸熱熔化,引起海平面上升。
7.晶體和非晶體的區分標準是:
晶體有固定熔點,熔化時溫度不變繼續吸熱;而非晶體沒有固定的熔點,熔化時溫度升高,繼續吸熱。
常見的晶體有:冰、食鹽、萘、各種金屬、海波、石英等
常見的非晶體有:松香、玻璃、蠟、瀝青等
8.影響熔點、凝固點的因素
①壓強。平常所說的物質的熔點,通常是指一個大氣壓時的情況。對于大多數物質,熔化過程是體積變大的過程,當壓強增大時,這些物質的熔點升高;對于像鉍、銻、冰來說,熔化過程是體積變小的過程,當壓強增大時,這些物質的熔點降低。
②物質中混有雜質。純凈水和海水的熔點有很大的差異。
四、凝華
1.凝華定義:
物質從氣態變成固態的過程,需要放熱。
2.凝華現象:
①霜和雪的形成(水蒸氣遇冷凝華而成)
②冬天看到樹上的“霧凇”
③冬天,外界溫度極低,窗戶內側可看見“冰花”(室內水蒸氣凝華)
五、升華
1.升華定義:
物質從固態變成氣態的過程,需要吸熱。
2.升華現象:
①加熱碘,可以看到有紫紅色的碘蒸氣出現。
②衣柜中防蟲用的樟腦片,會慢慢變小,最后不見了。
③冬天,濕衣服放在戶外會結冰,但最后也會晾干。(冰升華成水蒸氣)
3.升華吸熱:
①干冰可用來冷藏物品。(干冰是固態二氧化碳,升華成氣態時,吸收大量的熱)
六、液化
1.液化定義:
物質從氣態變成液態的過程,需要放熱。
2.液化現象:
①水開后,壺嘴看見“白氣”(壺中汽化出水蒸氣,遇到冷空氣液化成霧狀小水珠)
②夏天自來水管和水缸上會“出汗”。(空氣中的水蒸氣遇冷液化成水珠)
3.液化的方法分為:
降低溫度、壓縮體積兩種方法
3.1降低溫度(遇冷、放熱)液化:
①霧與露的形成(空氣中水蒸氣遇冷液化成霧狀小水珠;附在塵埃浮在空中,形成“霧”;附在草木,聚成“露”)
②冬天,嘴里呼出“白氣”。夏天,冰棍周圍冒“白氣”。(水蒸氣遇冷液化成霧狀小水珠)
③冬天,窗戶內側常看見模糊的“水氣”。(屋內水蒸氣遇到冷玻璃液化成小水珠)
④牙醫在為病人檢查牙齒時,將檢查用的小鏡子在酒精燈上稍微烤一下,然后放入口腔中。(防止口腔內的水蒸氣遇冷液化成小水珠附在鏡面上)
3.2壓縮體積液化:
①在常溫下,將石油氣壓縮放入鋼瓶中,以液態石油氣的形式保存。
②“長征”火箭的燃料和助燃劑分別是:壓縮成的“液態氫”和“液態氧”。
③打火機中,常用壓縮后的液態“丁烷”作為燃料。
4.液化放熱:
①北方的冬天,在室內暖氣管道中通以灼熱的水蒸氣來取暖,最后在管道另一頭回收到的是水。(水蒸氣液化成水放出大量熱)
②100℃的水蒸氣比100℃的水更容易燙傷人體。(100℃的水蒸氣液化成100℃的水要放熱)
七、汽化
1.汽化:
物質從液態變成氣態的過程,需要吸熱。
2.汽化現象分為:
沸騰、蒸發,兩種形式都要吸熱。
八、沸騰和蒸發的區別
1.沸騰:
1.1沸騰現象:例-水沸騰,有大量的氣泡上升,變大,到水面破裂,釋放出水蒸氣。
1.2沸騰規律:液體在沸騰時,要不斷地吸熱,但溫度保持在沸點不變。
1.3液體沸騰必要條件:
溫度達到沸點、不斷吸熱。
1.4有關沸點知識:
①液態氧的沸點是-183℃,固態氧的熔點是-218℃。-182℃時,氧為氣態。
-184℃時,氧為液態。-219℃時,氧為固態。-183℃氧是液態、氣態或氣液共存都可以。
②可用紙鍋將水燒至沸騰。(水沸騰時,保持在100℃不變,低于紙的著火點)
③裝有酒精的塑料袋擠癟(排盡空氣)后,放入80℃以上的水中,塑料袋變鼓了。
(酒精汽化成了蒸氣。酒精沸點為78℃,高于78℃時為氣態)
2.蒸發:
2.1蒸發現象:
①濕衣服放在戶外,很快就會干
②教室灑過水后,水很快就干了
2.2蒸發吸熱,有致冷作用:
①剛從水中出來,感覺特別冷。(風加快了身上水的蒸發,蒸發吸熱)
②一杯40℃的酒精,敞口不斷蒸發,留在杯中的酒精溫度低于40℃。(蒸發要向周圍環境和液體自身吸熱。)
③在室內,將一支溫度計從酒精中抽出,示數會先下降再升高。(酒精蒸發吸熱,使溫度計中液體溫度下降,蒸發結束后溫度回升到室溫)
歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看