來源:網絡資源 2023-01-08 19:23:41
常見的酸
1.生活中常用的酸:胃液中含有的鹽酸(HCl),蓄電池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH或HAc);飲料中可能含有的碳酸、檸檬酸等。
2.酸的分類:無氧酸(如HCl)、含氧酸(HNO3、H2SO4)等。
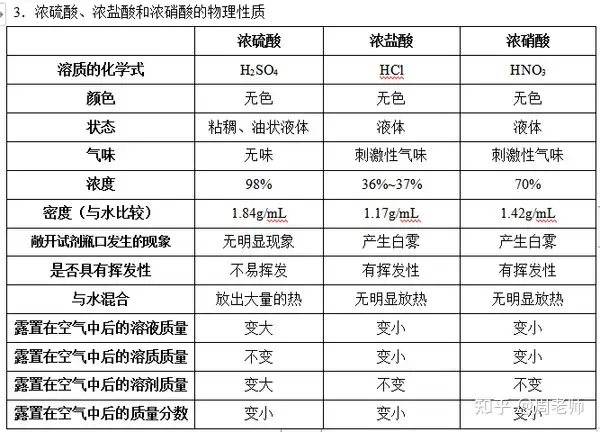
注意:濃硫酸具有一定的特性:
(1)吸水性(物理性質)用于氣體干燥,但除NH3等堿性氣體除外[2NH3+ H2SO4== (NH4)2SO4]
(2)脫水性(化學性質)——黑面包實驗(濃硫酸與蔗糖反應,使之炭化。)
(3)強氧化性,腐蝕性——與金屬發生反應,生成的氣體不生成氫氣而是二氧化硫。
在加熱的條件下,能與排在氫后面的金屬(如Cu)反應,如:
Cu+2H2SO4(濃)△==CuSO4+SO2↑+H2O
又如,冷的濃硫酸與鐵或鋁反應后,能生成一層致密的氧化膜,阻止反應進一步進行。
(4)濃硫酸的稀釋:酸入水,沿器壁,不斷攪拌。
濃硫酸溶于水放出大量的水,足以使水分沸騰,并且水的密度小于濃硫酸的密度。如果把水倒入濃硫酸中,水就會浮在濃硫酸上面,溶解時放出大量的熱,致使水沸騰而使硫酸液滴向四周飛濺而造成事故。
(5)安全事故的處理:濃硫酸濺到皮膚上后,首先迅速用抹布將其擦拭,然后用大量水沖洗,最后用3%~5%的NaHCO3涂敷。
稀硫酸濺到皮膚上后,應該馬上沖洗,因為隨著稀硫酸中溶劑的蒸發,也會變成濃硫酸。
4.酸的化學性質
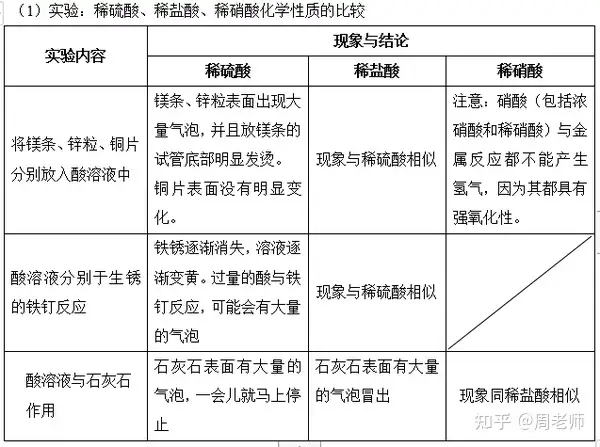
總結:酸所具有的共同特點:
酸在水溶液中都能電離出氫離子,因此酸溶液會具有許多共同的性質(酸的五大通性):
(1)酸溶液與酸堿指示劑的反應
A.紫色石蕊試液或藍色石蕊試紙遇到酸溶液變紅色;
B.無色酚酞試劑遇到酸溶液不變色。
提醒:紫色石蕊試劑變色情況為:“酸紅堿藍”;是指示劑變色,而非待測溶液本身變色。
(2)酸溶液與某些金屬反應
酸溶液+ (氫前)金屬→ 鹽溶液+ 氫氣
注意:
A.在金屬活動性順序表中,排在氫前面的金屬能置換出酸中的氫,排在氫后面的金屬則不能;
B.排在金屬活動性順序表越前面的金屬,反應現象越劇烈,速度越快,如Mg反應有明顯放
熱現象;
C.強氧化性酸與金屬反應后,不能生成氫氣,而是生成水。如濃硫酸、硝酸等強氧化性酸;
D.該類反應屬于置換反應
如:Zn + 2HCl == ZnCl2+ H2↑;Fe + H2SO4== FeSO4 + H2↑
(3)酸溶液與某些金屬氧化物反應(金屬氧化物又稱堿性氧化物)
酸溶液+ 金屬氧化物→ 鹽溶液+ 水
注意:該反應過程中,金屬元素的化合價不變,酸中的原子團不變
如:CuO + 2HCl == CuCl2+ H2O;Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O
ZnO + 2HNO3== Zn(NO3)2+H2O
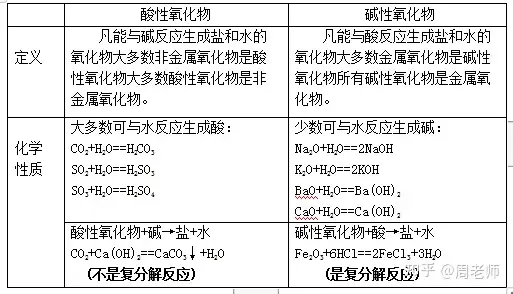
(4)酸溶液與堿的反應(又稱為中和反應)
酸+堿→鹽+水
(5)酸溶液與某些鹽反應
酸溶液+ 鹽→ 新酸+ 新鹽
注意:A.我們通常遇到的鹽是碳酸鹽,因此絕大部分反應是:
酸+ 碳酸鹽→ 新鹽+ 水+ 二氧化碳
如:CaCO3+ 2HCl == CaCl2+ H2O + CO2↑;Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑;
K2CO3+ 2HNO3== 2KNO3+ H2O + CO2↑;
MgCO3+ CH3COOH == (CH3COO)2Mg + H2O + CO2↑;
B.某些特殊的鹽能與酸反應,生成特殊的沉淀
如:HCl + AgNO3== AgCl↓+ HNO3;BaCl2+ H2SO4== BaSO4↓+ 2HCl
補充:Cl-及SO42-的檢驗
A.向待測溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,則溶液中含有Cl-,如果沒有沉淀或者沉淀消失,則不含有Cl-。
B.向待測溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,則溶液中含有SO42-,如果沒有沉淀或者沉淀消失,則不含有SO42-。
歡迎使用手機、平板等移動設備訪問中考網,2024中考一路陪伴同行!>>點擊查看