來源:網絡資源 2023-01-08 20:52:37
初中總復習——化學實驗綜合
【知識掌握】
【知識點精析】
1. 常見物質的名稱、化學式、俗稱及主要物理性質
名稱
化學式
俗稱
主要物理性質
硫
S
硫磺
黃色固體,不溶于水;易溶于有機溶劑。
二氧化碳
CO2
固體俗稱干冰
無色氣體、能溶于水、密度比空氣大,固體干冰易升華。
一氧化碳
CO
煤氣
無色、無味氣體、難溶于水,
密度比空氣略小,有毒性。
甲烷
CH4
沼氣、坑氣
無色、無味氣體,極難溶于水,
密度小于空氣。
乙醇
C2H5OH
酒精
無色透明,具有特殊氣味的易
揮發的液體,可與水任意互溶。
乙酸
CH3COOH
醋酸、冰醋酸
無色有刺激性酸味的液體,易
溶于水,固體稱冰醋酸。
氧化鈣
CaO
生石灰
白色固體,易吸水,有腐蝕性。
氧化鐵
Fe2O3
鐵銹、赤鐵礦
紅色固體,不溶于水。
四氧化三鐵
Fe3O4
磁鐵礦
黑色固體,不溶于水。
氫氧化鈉
NaOH
火堿、燒堿、苛性鈉
白色固體,極易溶于水,易潮
解,有強腐蝕性。
氫氧化鈣
![]()
熟石灰、消石灰、
石灰水
白色粉末狀固體,微溶于水,有
腐蝕性。
碳酸鈉
Na2CO3
純堿、口堿、蘇打
白色粉末狀固體,易溶于水且吸
濕結塊。
碳酸鈉晶體
Na2CO3·10H2O
無色晶體,易失水風化。
碳酸氫鈉
NaHCO3
小蘇打
白色晶體,易溶于水,但溶解度
比
![]()
小。
氯化鈉
![]()
食鹽
碳酸鈣
![]()
石灰石、大理石
白色固體,不溶于水。
硫酸銅
![]()
白色粉末狀固體,溶于水,其水
溶液為藍色。
硫酸銅晶體
![]()
藍礬、膽礬
藍色晶體。
高錳酸鉀
![]()
灰錳氧
紫色有光澤晶體,溶于水,其水
溶液為紫色。
堿式碳酸銅
![]()
銅綠
綠色粉末狀固體,不溶于水。
氯化銀
![]()
新制得為白色凝乳狀沉淀,不溶
于稀硝酸。
硫酸鋇
BaSO4
天然產稱重晶石
白色固體,不溶于水,不溶于稀
硝酸。
氫氧化鐵
![]()
新制得為紅褐色沉淀。
氫氧化銅
![]()
新制得為藍色沉淀。
2. 幾種常見藥品的存放
藥品
性質
保存方法
白磷
著火點低,易自燃,不跟水反應
放入冷水中
濃硫酸
易吸收空氣中的水分(吸水性)
放入玻璃瓶內,瓶塞要嚴
濃鹽酸
易揮發
放入玻璃瓶內,瓶塞要嚴
濃硝酸
易揮發
放入玻璃瓶內,瓶塞要嚴
氧化鈣
易吸水,易與空氣中二氧化碳反應而變質
密封于干燥試劑瓶中
固體氫氧化鈉
易潮解,易與空氣中二氧化碳反應而變質
密封于干燥試劑瓶中
堿溶液的玻璃瓶應用橡膠塞密封。
3. 物質的檢驗
(1)常見氣體的檢驗
物質
檢驗的方法、步驟
現象
化學反應原理
備注
氧氣
![]()
帶火星的木條伸入瓶中
木條復燃
C+O2
![]()
CO2
氫氣
![]()
⑴點燃
⑵ 火焰上方罩一冷而干燥的燒杯。
⑴ 產生淡藍色火焰。
⑵ 燒杯壁上有水霧或水珠生成。
2H2+O2
![]()
2H2O
不純時有爆鳴聲
二氧化碳
![]()
⑴ 燃著的木條伸入集氣瓶
⑵ 加入澄清石灰水
⑴ 木條熄滅;
⑵ 石灰水變渾濁。
Ca(OH)2+CO2==CaCO3↓+H2O
一氧化碳
![]()
⑴ 點燃;
⑵ 火焰上方罩一干燥燒杯;
⑶ 燒杯中注入澄清石灰水。
⑴ 產生藍色火焰;
⑵ 燒杯壁無水珠;
⑶ 石灰水變渾濁。
2CO+O2
![]()
CO2
Ca(OH)2+CO2==CaCO3↓+H2O
不純時有爆鳴聲
甲烷
![]()
⑴ 點燃;
⑵ 火焰上方罩一干燥燒杯;
⑶ 燒杯中注入澄清石灰水。
⑴ 產生明亮的藍色火焰;
⑵ 燒杯壁有水珠;
⑶ 石灰水變渾濁。
CH4+2O2
![]()
CO2+2H2O
Ca(OH)2+CO2==CaCO3↓+H2O
不純時有爆鳴聲
氯化氫
![]()
⑴ 有刺激性氣味
⑵ 用潤濕的藍色石蕊試紙
⑶ 在空氣中有白霧
⑷ 通入
![]()
溶液中
⑵ 使藍色石蕊試紙變紅。
⑷
![]()
溶液產生白色沉淀。
HCl=H++Cl-
AgNO3+HCl=AgCl↓+HNO3
氨氣
![]()
⑴ 有特殊刺激性氣味;
⑵ 利用濕潤的紅色石蕊試紙。
⑴ 有氨臭味;
⑵ 濕潤石蕊試紙由紅色變藍色。
![]()
![]()
氮氣
![]()
⑴ 燃著木條伸入集氣瓶;
⑵ 加入澄清石灰水
⑴ 木條熄滅;
⑵ 石灰水依然澄清。
(2)幾種重要物質的檢驗
物質
所用試劑
檢驗的方法、步驟
現象
化學反應實例
酸
![]()
⑴ 紫色石蕊試液
取少量酸于試管并加入幾滴石蕊試液。
石蕊試劑由紫色變為紅色。
⑵ 無色酚酞試液
取少量酸于試管并加入幾滴酚酞試液。
無色酚酞試液不變色。
⑶ PH試紙
蘸取少量酸滴在
![]()
試紙上。
![]()
堿
![]()
⑴ 紫色石蕊試液
取少量堿液于試管中并加入幾滴石蕊試液。
石蕊試劑由紫色變為藍色。
⑵ 無色酚酞試液
取少量堿液于試管中并加入幾滴酚酞試液。
無色酚酞試液由無色變為紅色。
⑶ PH試紙
蘸取少量堿液滴在
![]()
試紙上。
![]()
鹽酸及可溶性氯化物
![]()
![]()
試劑和稀
⑴ 取少量待測液于試管中
⑵ 滴入幾滴
![]()
試劑并滴加稀
產生不溶于稀
![]()
的白色凝乳狀沉淀。
![]()
![]()
硫酸及可溶性硫酸鹽
![]()
![]()
試劑和稀
⑴ 取少量待測液于試管中
⑵ 滴入幾滴
![]()
試劑并滴加稀
生成不溶于稀
![]()
的白色沉淀。
![]()
![]()
碳酸鹽
![]()
![]()
或稀,澄清石灰水
⑴ 取少量待測固體或溶液于試管;
⑵ 加入幾滴稀
![]()
或稀;
⑶ 將生成的氣體通入澄清石灰水。
冒出氣泡,氣體能使澄清石灰水變渾濁。
![]()
![]()
![]()
![]()
銨鹽
![]()
⑴ 堿或堿液
⑵ 紅色石蕊試紙
⑴ 取少量待測固體或溶液于試管;
⑵ 加入堿或堿液共熱;
⑶ 將產生的氣體接觸濕潤的紅色石蕊試紙。
⑴ 有刺激性氣體生成;
⑵ 該氣體使濕潤的紅色石蕊試紙變藍。
![]()
![]()
![]()
4. 常見氣體的實驗室制取和物質性質的實驗
(1)氣體的發生裝置
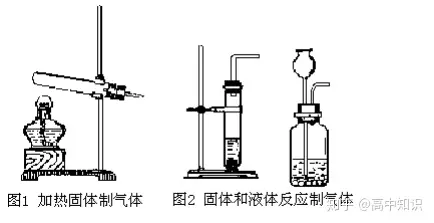
(2)氣體的收集裝置
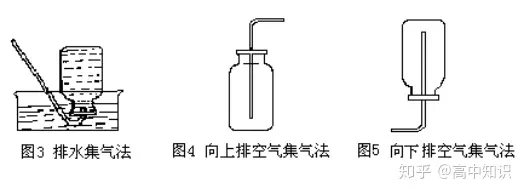
① 排水集氣法
② 向上排空氣集氣法
③ 向下排空氣集氣法(集氣瓶口向下)。
(3)氣體驗純與驗滿方法
(4)實驗室制取氧氣、氫氣和二氧化碳使用的藥品及反應原理
氣體
藥品
反應原理
O2
氯酸鉀、二氧化錳或高錳酸鉀
![]()
↑,↑
H2
鋅粒、稀硫酸
Zn+H2SO4(稀)===ZnSO4+H2↑
CO2
大理石或石灰石、稀鹽酸
CaCO3+2HCl===CaCl2+H2O+CO2↑
5. 常見氣體雜質的除法
氣體雜質
方法或試劑
H2
通過灼熱的氧化銅,然后再除去產生的水蒸氣。
CO
通過灼熱的氧化銅,然后再除去產生的
![]()
O2
通過熾熱的銅網。原理:
![]()
CO2
通過澄清石灰水或
![]()
溶液。(后者吸收效果更好)
![]()
通過無水硫酸銅或濃硫酸。(后者在除水時常用)
![]()
通過
![]()
溶液或等堿性溶液中(后者吸收效果好)
6. 常見物質的分離和提純
(1)過濾法
(2)蒸發法
(3)結晶法
(4)沉淀法
(5)氣化法
(6)轉化法
(7)溶解法
(8)吸收法
7. 課本上的重點實驗
(1) 空氣中氧氣含量的測定
(2) 燃燒的條件
(3) 分子的運動
(4) 水的組成
(5) 驗證質量守恒定律
歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看