來源:網絡資源 2023-06-13 14:27:32
堿及堿的通性
定義:電離時生成的陰離子全部是OH-離子。堿是由金屬離子(或銨根離子)和氫氧根離子構成。
1.氫氧化鈉、氫氧化鈣的物理性質、用途
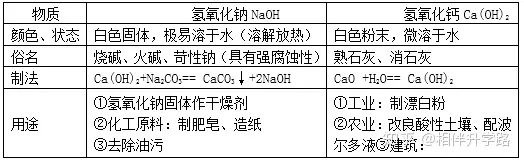
2.堿的通性
堿使紫色石蕊試液變藍,使無色酚酞試液變紅。
氫氧化鈉使紫色石蕊試液變藍,無色酚酞試液變紅。
氫氧化鈣使紫色石蕊試液變藍,無色酚酞試液變紅。
酸性氧化物+堿→鹽+水
2NaOH+CO2=Na2CO3+H2O Ca(OH)2+CO2=CaCO3↓+H2O
酸+堿→鹽+水
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4= CaSO4+2H2O
鹽+堿→另一種鹽+另一種堿
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
注意:(1)只有可溶性堿才能跟一些非金屬氧化物發生反應,這些非金屬氧化物是酸性氧化物。酸性氧化物多數能溶于水,跟水化合生成酸。
(2)鹽和堿反應時,必須兩者都是可溶的,且生成物之一是沉淀,反應才能進行。
(3)書寫堿跟某些金屬氧化物反應的化學方程式
關于這類反應化學方程式的書寫有同學感到很困難,為此,可先寫出非金屬氧化物跟水反應,生成含氧酸的化學方程式,再以含氧酸和堿相互交換成分寫出生成物。兩式合并成一個化學方程式。
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2024中考一路陪伴同行!>>點擊查看