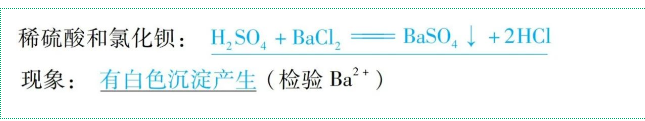第一部分 常見的酸
1. 定義:
在水溶液中解離時(shí)產(chǎn)生的陽離子全部是氫離子(或H+)的化合物
2. 常見酸的特性及用途
(1)鹽酸
① 濃鹽酸具有揮發(fā)性,敞口放置時(shí)瓶口形成白霧,有刺激性氣味;純凈的濃鹽酸是無色的液體
② 用途:用于金屬除銹、電鍍、化工生產(chǎn)等。人體胃液中含有鹽酸,可幫助消化
(2)硫酸
① 不易揮發(fā),無味;純凈的濃硫酸是無色、黏稠的油狀液體
② 濃硫酸的特性:
吸水性:實(shí)驗(yàn)室中常用來作氣體干燥劑
脫水性:可使蔗糖、紙張等脫水而炭化
腐蝕性:如果不慎將濃硫酸沾到皮膚上,應(yīng)立即用大量水沖洗,然后涂上3%~5%的碳酸氫鈉(或NaHCO3)溶液
③ 用途:用于金屬除銹、生產(chǎn)車用電池、化肥、農(nóng)藥、精煉石油等
3.化學(xué)通性(酸5條)
酸具有通性的原因是:在水溶液中都能解離出H+(或氫離子)
(1)與酸堿指示劑反應(yīng):
能使紫色石蕊溶液變紅,不能使無色酚酞溶液變色
(2)與活潑金屬反應(yīng):
通式:酸+活潑金屬→鹽+H2↑(置換反應(yīng))
舉例:

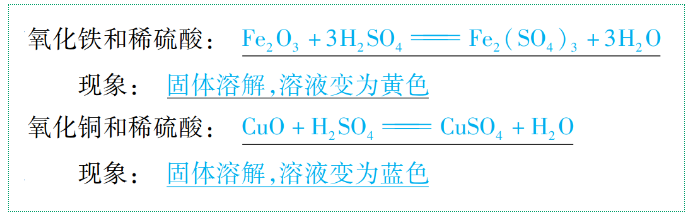
(3)與某些金屬氧化物反應(yīng)
通式:酸+金屬氧化物→鹽+H2O(復(fù)分解反應(yīng))
舉例:
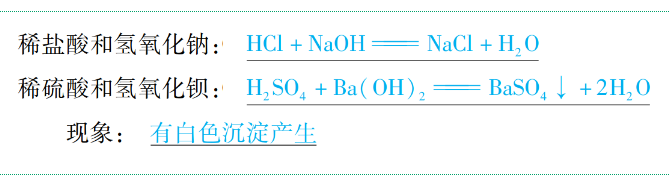
(4)與堿反應(yīng)
通式:酸+堿→鹽+H2O(復(fù)分解反應(yīng))
舉例:
(5)與某些鹽反應(yīng)
通式:酸+鹽→新酸+新鹽(酸+碳酸鹽→新鹽+H2O+CO2↑)(復(fù)分解反應(yīng))
舉例:

【注意】不同酸具有“個(gè)性”的原因是:含有的酸根離子(或陰離子)不同。
如:
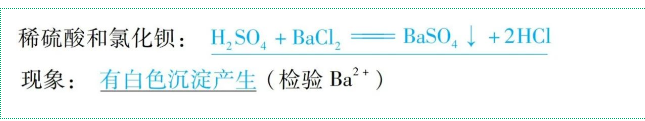
編輯推薦:
2023年中考各科目重點(diǎn)知識(shí)匯總
最新中考資訊、中考政策、考前準(zhǔn)備、中考預(yù)測(cè)、錄取分?jǐn)?shù)線等
中考時(shí)間線的全部重要節(jié)點(diǎn)
盡在"中考網(wǎng)"微信公眾號(hào)

歡迎使用手機(jī)、平板等移動(dòng)設(shè)備訪問中考網(wǎng),2023中考一路陪伴同行!>>點(diǎn)擊查看