來源:網絡資源 2023-08-12 21:25:12
一、溶液的形成
1. 溶液
(1)概念:
一種或幾種物質分散到另一種物質里,形成均一的、穩定的混合物
(2)特征:
均一性、穩定性
(3)組成
① 溶質:被溶解的物質,可以是固體、液體、氣體
② 溶劑:能溶解其他物質的物質。水是最常用的溶劑,汽油、酒精等也可以作溶劑
2. 溶解
(1)吸熱:
一些物質溶于水后,整個過程中溶液溫度降低,如NH4NO3(或硝酸銨)固體
(2)放熱:
一些物質溶于水后,整個過程中溶液溫度升高,如NaOH固體、濃H2SO4
(3)吸放熱不明顯:
多數物質溶于水后,整個過程中溶液溫度變化不明顯,如NaCl固體
【注意】
a. 氧化鈣遇水放熱是因為氧化鈣與水反應放熱
b. 吸熱、放熱現象通常會引起密閉容器內壓強的變化
二、乳化
1. 乳化現象:
洗滌劑等乳化劑能使植物油等在水中分散成無數細小的液滴,而不聚集成大的油珠,從而使油和水不再分層,所形成的乳濁液穩定性增強,這種現象稱為乳化
2. 應用:
利用洗滌劑的乳化作用清洗餐具上的油污等
三、飽和溶液與不飽和溶液
1. 概念
(1)不飽和溶液:在一定溫度下,一定量溶劑里,還能繼續溶解這種溶質的溶液
(2)飽和溶液:在一定溫度下,一定量溶劑里,不能繼續溶解這種溶質的溶液
2. 判斷依據
(1)根據能否繼續溶解該物質判斷:在溫度、溶劑的量不變時,繼續向溶液中加入該物質,觀察是否溶解,若不再溶解則為飽和溶液,反之,則為不飽和溶液
(2)根據溶解的量判斷
3. 轉化

【注意】
析出晶體后的溶液一定是同條件下的飽和溶液
四、結晶
1. 概念:
溶質從溶液中以晶體的形式析出的過程
2. 方法
(1)蒸發結晶:通過蒸發溶劑的方法使溶質析出,適用于溶解度受溫度影響較小的物質,如氯化鈉
(2)降溫結晶(冷卻熱飽和溶液):通過降溫的方法使溶質析出,適用于溶解度隨溫度升高而明顯增大的物質,如硝酸鉀
五、溶解度及溶解度曲線
1. 溶解度
(1)固體溶解度
① 概念:在一定溫度下,某固態物質在100g溶劑里達到飽和狀態時所溶解的質量
② 影響因素
內因:溶質、溶劑本身的性質
外因:溫度【多數固體物質溶解度隨溫度的升高而增大,但NaCl(變化不大)、Ca(OH)2(降低)等除外】
(2)氣體溶解度
① 概念:在壓強為101kPa和一定溫度時,溶解在1體積水里達到飽和狀態時的氣體體積
② 影響因素
內因:溶質、溶劑本身的性質
外因:溫度(溫度越高,氣體的溶解度越小)、壓強(壓強越大,氣體的溶解度越大
2. 溶解度曲線(針對固體溶質)
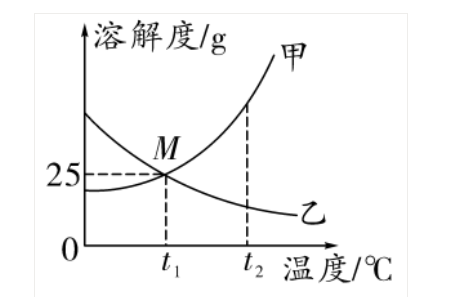
(1)概念:
溶解度隨溫度變化的曲線。縱坐標表示溶解度,橫坐標表示溫度
(2)意義
① 點
曲線上的點:表示物質在對應溫度下的溶解度
兩曲線的交點:表示兩物質在某溫度下溶解度相等
② 線
曲線的走向表示物質的溶解度隨溫度改變而變化的趨勢
曲線的陡緩表示物質溶解度受溫度影響的變化大小
六、溶液的定量組成(濃度)
1. 溶質質量分數的計算公式

2. 溶液的稀釋
(1)原理:
稀釋前后,溶質質量不變
(2)公式:
A×a%=B×b%(其中a%、b%分別為稀釋前后溶質的質量分數,A、B分別為稀釋前后溶液的質量,即B=A+加入溶劑的質量)
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2024中考一路陪伴同行!>>點擊查看